MARCADORES SÉRICOS DE NECROSE MIOCÁRDICA
Instituto Dante Pazzanese de Cardiologia
Endereço para correspondência:
Av. Miruna, 327 — ap. 44 — Moema — CEP 04084-001 — São Paulo — SP
INTRODUÇÃO
Após a ocorrência de um evento cardíaco isquêmico agudo, quanto mais precoce for seu reconhecimento e conseqüente tratamento, menores serão a área de necrose e suas complicações e maior será a sobrevida do paciente. Os critérios da Organização Mundial da Saúde, utilizados nas últimas três décadas para diagnósticos de infarto agudo do miocárdio, baseiam-se na presença de dois dos três seguintes critérios: sintomas clínicos sugestivos de isquemia miocárdica, alterações eletrocardiográficas, e elevação e normalização das enzimas cardíacas.
Embora o quadro clínico seja de vital importância, em cerca de 30% dos pacientes, particularmente diabéticos e idosos, os sintomas podem ser inespecíficos.
O eletrocardiograma, um instrumento extremamente importante, acessível e rápido na avaliação desses pacientes, depende de análise correta e de um intérprete treinado; além disso, alterações já existentes podem confundir o diagnóstico se não houver um traçado anterior para comparação.(1) Pacientes com supradesnivelamento do segmento ST acima de um milímetro ou novo bloqueio completo de ramo são candidatos a reperfusão miocárdica.
Embora, há décadas, a dosagem das enzimas cardíacas seja considerada o método de escolha para a confirmação diagnóstica de infarto agudo do miocárdio, com a introdução dos novos marcadores bioquímicos de lesão miocárdica, as condutas no manuseio dos pacientes com dor torácica têm mudado substancialmente.
HISTÓRICO
O primeiro marcador de lesão miocárdica utilizado para o diagnóstico de infarto agudo do miocárdio, descrito, em 1954, por Karmen e colaboradores, foi a aspartato aminotransferase (antiga transaminase glutâmico-oxaloacética)(2). Um ano após, os mesmos investigadores descreveram o papel diagnóstico da desidrogenase láctica. Em 1960, Oliver e colaboradores descreveram o uso da creatina cinase, cuja técnica, modificada por Rosalki em 1965, é utilizada até hoje. Com o reconhecimento precoce da falta de especificidade da aspartato aminotransferase, da desidrogenase láctica e da creatina cinase para o diagnóstico de lesão do miocárdio, as isoenzimas da creatina cinase tornaram-se importantes para melhorar o poder diagnóstico. Desenvolveram-se, então, os testes de eletroforese para a medida dessas isoenzimas e da desidrogenase láctica, reconhecidas como mais específicas para lesão miocárdica que a creatina cinase.
Como esse método não permitia rapidez diagnóstica e pela dificuldade de sua automatização, desenvolveram-se os testes de imunoinibição, em 1975. Esses testes utilizaram anticorpos específicos contra a subunidade M da CK-MM ou CK-MB e passaram a ser utilizados de rotina em razão de seu baixo custo, da disponibilidade e da facilidade de realização do exame(3). Os marcadores iniciais eram enzimas, e a medida de sua atividade permitia determinar a extensão da lesão miocárdica. Desenvolveram-se, então, testes imunológicos para dosar a concentração protéica do marcador, independentemente de a enzima estar ativa ou não. Empregando a técnica de radioimunoensaio, a mioglobina foi o primeiro marcador protéico a ser investigado, em 1975, mas o tempo necessário para a realização do exame e a necessidade de material radioativo limitaram sua utilização naquela época(4). Em 1979, a Organização Mundial da Saúde estabeleceu os critérios diagnósticos de infarto agudo do miocárdio e incluiu as enzimas como parte da tríade diagnóstica(5).
Em 1985, foi descrito o primeiro teste de CK-MB massa usando anticorpo anti CK-M e anti CK-B. No ano seguinte, foi desenvolvido o teste anti CK-MB, cujos princípios são utilizados até hoje(3).
Os testes de troponina T (cTnT) e de troponina I (cTnI) para diagnóstico de infarto agudo do miocárdio foram descritos em 1989 e 1992, respectivamente(3). Em 1994, Hamm e colaboradores(6) demonstraram, pela primeira vez, o papel da cTnT na estratificação de risco de pacientes(6), resultados confirmados em 1996 em um grande estudo(7). Em 1997 e 1998, foram publicados estudos demonstrando que portadores de síndrome coronariana aguda com níveis anormais de cTnT apresentavam benefício quando tratados com determinadas medicações, em relação a pacientes com troponina negativa, os quais não apresentaram nenhum benefício(8, 9).
Em 1998, Collinson(10) ressaltou o papel dos testes à beira do leito, que são qualitativos, demonstrando que estes possibilitam rápido diagnóstico e que possuem boa relação custo-eficácia, quando a rápida obtenção do resultado é imprescindível(10).
CREATINA CINASE (CK)
A creatina cinase é um dímero e também uma importante enzima reguladora na produção e na utilização do fosfato de alta energia nos tecidos contráteis. Catalisa a fosforilação da creatina produzida nos rins, no fígado e no pâncreas pelo trifosfato de adenosina para formar o fosfato de creatina e o difosfato de adenosina. Sua análise no sangue é realizada por meio da espectrofotometria, utilizando o método de Rosalki, universalmente aceito e usado nos laboratórios clínicos(11).
A atividade da CK no sangue é o resultado da contração e do relaxamento do músculo esquelético, e seus níveis sanguíneos dependem da atividade física do indivíduo e de sua massa muscular. No adulto masculino, seu intervalo de referência varia de 80 UI/l a 200 UI/l e no feminino, de 60 UI/l a 140 UI/l a 370C. Assim, os idosos têm menor nível de CK circulante, em decorrência, principalmente, do sedentarismo e da atrofia da massa muscular, elevando-se pouco no infarto agudo do miocárdio em relação aos jovens. Em pacientes sedentários e na presença de pequenos infartos, eleva-se pouco e pode não ultrapassar o limite superior da normalidade.
Embora seja um indicador sensível de lesão muscular, não é específico para o diagnóstico desse fenômeno. Eleva-se na circulação sanguínea quatro a seis horas após o início dos sintomas, atinge o pico entre 14 e 18 horas e normaliza-se entre 48 e 72 horas.
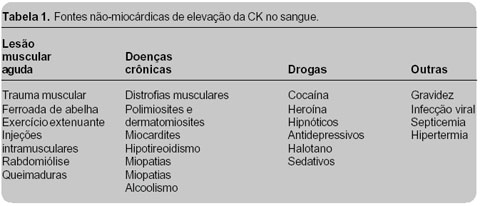
Resultados anormais da atividade da CK podem ocorrer em decorrência de
problemas intrínsecos aos testes laboratoriais, às doenças associadas que
diminuem o "clearance" de proteínas, à liberação de tecidos necróticos com
níveis elevados da enzima, às lesões musculares periféricas agudas e crônicas, e
ao uso de certos medicamentos e de drogas ilícitas, como demonstrado na Tabela
1.
 |
Com o desenvolvimento de novos marcadores mais sensíveis e específicos para o diagnóstico de lesão miocárdica, como a dosagem da concentração protéica da CK-MB e das troponinas, a utilização da CK seria, atualmente, uma medida de exceção, na indisponibilidade de marcadores mais modernos.
ISOENZIMAS DA CK: CK-MM, CK-BB E CK-MB
A CK é composta por três isoenzimas. A combinação de duas subunidades, M (muscular) e B (cerebral), forma essas três isoenzimas — CK-MM, CK-BB e CK-MB —, cujo peso molecular varia de 86 kda a 89 kda.
A CK-MM é designada como forma muscular periférica, na qual sua concentração é de 96% a 99%; no músculo cardíaco, é de 70% a 98%. A CK-BB é denominada forma cerebral, pois sua concentração é de 100% nesse órgão. Também pode ser encontrada em concentrações acima de 92% na musculatura lisa dos aparelhos digestivo e urinário e na próstata. É liberada, também, na presença de neoplasias, como mama, cólon e próstata. A CK-MB é encontrada na concentração de 2% a 30% no músculo cardíaco e de 1% a 4% no músculo periférico(11, 12).
Nas últimas três décadas, a medida da atividade da CK-MB tem sido o marcador padrão para diagnóstico do infarto agudo do miocárdio. Seu intervalo de referência depende do método utilizado para sua medida, e seu valor superior de normalidade varia entre 10 UI/l e 25 UI/l.
Embora possua a mesma sensibilidade da CK para o diagnóstico de lesão miocárdica, a CK-MB é mais específica, mas eleva-se também em outras situações, como cardiopatias e cirurgias cardíacas, na presença de lesões musculares periféricas e na presença de doença maligna (Tab. 2).
Para aumentar a especificidade diagnóstica da CK-MB, é utilizado o índice relativo da CK-MB, dado pela equação: 100 x CK-MB/CK. Se o resultado for inferior a 4%, sugere a presença de lesão muscular periférica; se for entre 4% e 25%, sugere infarto agudo do miocárdio; e se for acima de 25%, deve ser considerada a presença de macroenzimas. Esse índice perde sua acurácia na presença de doenças com grande regeneração muscular e na presença de lesões musculares extensas com alterações importantes das concentrações dessas enzimas(12, 13).
As macroenzimas podem ser diagnosticadas em até 4% dos pacientes
hospitalizados. Possuem peso molecular que varia de 250 kda a 750 kda, por
polimerizacão ou associação com outros componentes sanguíneos. Conhecem-se dois
tipos de macroenzimas: a macro CK tipo 1, observada mais freqüentemente em
mulheres idosas e não está associada a doenças, e a macro CK tipo 2, encontrada
na presença de cirrose hepática e de doença metastática e está associada a mau
prognóstico(14, 15).
 |
Atualmente, a CK-MB atividade com curva característica e com elevação e normalização de seus níveis é o padrão para diagnóstico do infarto agudo do miocárdio. Eleva-se em quatro a seis horas após o início dos sintomas, com pico em torno de 18 horas, e normaliza-se entre 48 e 72 horas. Permite o diagnóstico tardio do infarto agudo do miocárdio, após 12 horas do início dos sintomas, quando sua sensibilidade é de cerca de 93%; porém, é pouco sensível para o diagnóstico precoce, isto é, nas primeiras seis horas.
ISOFORMAS DA CK-MB E DA CK-MM
As isoformas foram descritas, pela primeira vez, em 1972 e são variantes das isoenzimas da CK-MB e da CK-MM(16). A isoenzima da CK-MM possui três isoformas — MM3, MM2 e MM1 —, assim nomeadas por causa de sua migração durante a eletroforese. A MM3 é a forma tecidual pura. Após sua liberação na circulação sanguínea, sofre clivagem pela carboxipeptidase, transformando-se em MM2; com nova clivagem, transforma-se em MM1. Essas isoformas elevam-se precocemente na circulação sanguínea, entre uma e duas horas após o início dos sintomas, atingem o pico em 6 a 9 horas e normalizam-se entre 12 e 18 horas(17). A razão MM3/MM1 maior que 1,0 apresenta maior sensibilidade diagnóstica para o infarto agudo do miocárdio que suas dosagens isoladas.
A CK-MB possui duas isoformas: a MB2 e a MB1. A MB2 sofre clivagem na circulação sanguínea pela carboxipeptidase, transformando-se em MB1. São mais específicas para o diagnóstico de lesão miocárdica que as isoformas MM, o que faz com que sejam mais utilizadas. A razão MB2/MB1 maior que 1,5 UI/l apresentou sensibilidade de 12,5%, 59% e 92% para o diagnóstico de infarto agudo do miocárdio, quando dosada nos intervalos de zero a duas horas, duas a quatro horas, e quatro a seis horas após o início dos sintomas, respectivamente. A isoforma MB2 encontra-se elevada em 67% dos pacientes com infarto agudo do miocárdio, comparativamente a 27% para a CK-MB atividade(18).
As limitações para o uso das isoformas na prática clínica são as variações do nível circulante de carboxipeptidase, que podem levar a resultados falsos positivos e negativos, e a falta de um método quantitativo simples, rápido e custo efetivo para seu uso.
CONCENTRAÇÃO DA MASSA DA CK-MB (CK-MB MASSA)
Historicamente, a CK-MB tem sido medida pela eletroforese e pela imunoinibição. A utilização de testes imunológicos que dosam a concentração protéica da CK-MB em nanogramas por mililitro (ng/ml) melhorou sua sensibilidade clínica, sua especificidade analítica e a rapidez na realização do exame, e, sem dúvida, supera qualquer outra técnica de dosagem da CK-MB(19, 20). A CK-MB massa eleva-se entre três e seis horas após o início dos sintomas, com pico entre 16 e 24 horas, normalizando-se entre 48 e 72 horas. Uma meta-análise que examinou a dosagem da CK-MB para o diagnóstico do infarto agudo do miocárdio entre 12 e 48 horas após o início dos sintomas demonstrou sensibilidade de 96,8% (IC 95%: 95% a 98%) e especificidade de 89,6% (IC 95%: 87% a 92%)(21). Por esse motivo, muitos serviços vêm substituindo a medida da CK-MB atividade pela dosagem da massa da CK-MB para o diagnóstico do infarto.
Esses testes imunológicos são altamente precisos e permitem a detecção de baixas concentrações de CK-MB na circulação sanguínea. Por isso, pacientes com isquemia aguda podem apresentar elevações de seus níveis sem preencher os critérios para diagnóstico de infarto agudo do miocárdio.
Cerca de 30% dos pacientes admitidos com dor torácica apresentam elevação dos níveis de CK-MB massa sem atingir níveis compatíveis com infarto agudo do miocárdio. A meta-análise de sete estudos que avaliaram 621 pacientes, sem confirmação diagnóstica de infarto agudo do miocárdio, demonstrou que 490 (79%) apresentaram CK-MB massa negativa e 131 (21%), positiva. A incidência de infarto agudo do miocárdio não-fatal e óbito dos pacientes com níveis positivos foi de 34%, comparativamente a 5% daqueles com CK-MB massa negativa(22).
A avaliação do pico da CK-MB, em 8.250 pacientes que participaram do estudo PURSUIT ("Platelet Glycoprotein IIb/IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy"), demonstrou que a elevação da CK-MB está relacionada a maior mortalidade em pacientes com síndrome isquêmica aguda. Pacientes com níveis elevados de CK-MB evoluíram com maior mortalidade em 30 e 180 dias de seguimento em relação àqueles com níveis normais. Observou-se que o risco começa com níveis de CK-MB logo acima de seu valor superior de referência(23).
DESIDROGENASE LÁCTICA
A desidrogenase láctica (LD) pertence a uma classe de enzimas que catalisam as reações de oxirredução, e é distribuída em vários tecidos. Sua concentração mais elevada é encontrada no fígado, no coração, no rim, no músculo esquelético e nos eritrócitos. Seu peso molecular é de 135.000 kda, e é composta por cinco isoenzimas: LD1, LD2, LD3, LD4, LD5. A desidrogenase láctica é predominante no coração, mas também ocorre no rim, no estômago, no pâncreas, no cérebro e nos eritrócitos(20).
No infarto agudo do miocárdio, a desidrogenase láctica eleva-se entre 12 e 18 horas após o início dos sintomas, atinge o pico entre 48 e 72 horas, e normaliza-se em 10 dias. Em decorrência de sua inespecificidade e da especificidade das troponinas, que cobrem a mesma janela diagnóstica da desidrogenase láctica, não há mais indicação para seu uso.
MIOGLOBINA
A mioglobina, uma hemeproteína transportadora de oxigênio, citoplasmática, de baixo peso molecular (17,8 kda), é encontrada em músculo esquelético e cardíaco. Sua maior característica é a habilidade de se ligar ao oxigênio, com maior afinidade que a hemoglobina, provavelmente facilitando a difusão e o armazenamento de oxigênio nas fibras do músculo estriado. A contração e o relaxamento dos músculos estriados, em particular do músculo esquelético, causam a liberação contínua de mioglobina na circulação sanguínea, o que leva à detecção de mioglobina no soro de uma população de referência(24).
Seus valores de referência variam com a idade, o sexo e a raça, é eliminada pelos rins, e apresenta vida média de dez minutos. É rapidamente liberada pelo miocárdio necrótico e começa a elevar-se em torno de duas horas após o início dos sintomas, com pico entre seis e nove horas e normalização entre 12 e 24 horas(25).
A mioglobina é mais sensível que a CK e a CK-MB atividade. Essas diferenças, entretanto, são menos pronunciadas quando a mioglobina é comparada a isoformas da CK-MB e CK-MB massa.
Por seu elevado valor preditivo negativo, que varia de 83% a 98%, é considerada excelente para afastar o diagnóstico de infarto agudo do miocárdio(26). Esse valor preditivo negativo é importante somente em pacientes com alterações eletrocardiográficas que dificultem o diagnóstico de infarto agudo do miocárdio.
Embora seja sensível, não é um marcador específico, alterando-se na presença de lesões musculares, insuficiência renal crônica, exercícios extenuantes, e exposição a drogas e toxinas. Cerca de 25% dos pacientes em estado crítico apresentam elevação de seus níveis sanguíneos, mesmo na ausência de lesão cardíaca (4).
A utilização da dosagem simultânea de anidrase carbônica III e mioglobina poderá, no futuro, aumentar a especificidade da mioglobina. A anidrase carbônica III é uma proteína de músculo estriado periférico, liberada na razão de 1:1 com a mioglobina na presença de lesão muscular. Quando ambas forem positivas, será confirmado o diagnóstico de lesão periférica; se somente a mioglobina for positiva, será confirmado o diagnóstico de lesão miocárdica(27, 28).
A associação das dosagens de mioglobina e CK-MB massa na admissão e quatro horas após foi avaliada por Kontos e colaboradores(29) em 101 pacientes com suspeita de infarto agudo do miocárdio. A sensibilidade diagnóstica das dosagens realizadas na admissão foi de 70% e 30% para a mioglobina e a CK-MB massa, respectivamente, e de 85% e 90%, respectivamente, quatro horas após. Combinando-se os dois marcadores e ambas as dosagens, o valor preditivo negativo e positivo para o diagnóstico de infarto agudo do miocárdio foi de 100%.
Sua utilização em pacientes com dor torácica apresenta melhores resultados nas sete primeiras horas do início dos sintomas; após esse período, sua sensibilidade começa a diminuir e os marcadores mais específicos são mais efetivos. Seu desempenho não é consistente: quando positiva, necessita a associação de um marcador mais específico para a confirmação diagnóstica; quando negativa, não permite a estratificação de risco.
TROPONINAS
As troponinas estão presentes nos filamentos finos dos músculos estriados, formando um complexo com três polipeptídios — troponina C (TnC), troponina I (TnI) e troponina T (TnT) —, envolvidos com o mecanismo de regulação do cálcio celular. A TnC liga-se ao cálcio, a TnI inibe o acoplamento actinomiosina e a TnT liga o complexo triprotéico à tropomiosina. Existem três isoformas de TnI e de TnT, duas nos músculos periféricos: a de contração lenta, a de contração rápida e uma no músculo cardíaco. As formas cardíacas de troponina I e T (cTnI e cTnT) diferenciam-se das formas musculares periféricas por possuírem uma cadeia de aminoácidos diferente em suas moléculas. Isso as torna específicas para o coração(30).
Por serem diretamente ligadas ao complexo contrátil celular, são praticamente indetectáveis na circulação sanguínea; de 3% a 6% da fração da cTnI e de 4% a 8% da fração cTnT encontram-se no citoplasma, enquanto 94% a 97% da cTnI e 92% a 96% da cTnT encontram-se no arcabouço celular(12).
Apesar de a cTnI e de a cTnT possuírem o mesmo poder de estratificação de risco em pacientes com síndrome isquêmica aguda, devem ser consideradas proteínas distintas. A cTnT possui maior concentração tecidual e citoplasmática e é liberada na forma livre ou de complexo triplo (TIC). A cTnI é liberada na forma de complexo triplo ou complexo binário (IC), e menos de 10% são liberados na forma livre. Como as formas cardíaca e periférica da troponina C são semelhantes, acredita-se que a cTnI livre se ligue à troponina C, formando o complexo IC quando na circulação sanguínea.
Embora as troponinas possuam peso molecular baixo, de 23 kda para a cTnI e de 39 kda para a cTnT, elas atingem a circulação sanguínea em tempo semelhante ao da CK-MB. Isso ocorre porque são liberadas em forma de complexo TIC, com peso molecular semelhante ao da CK-MB, ou seja, 84 kda(31). Não permitem, portanto, diagnóstico precoce de infarto agudo do miocárdio. Elevam-se entre três e oito horas após o início dos sintomas, com pico entre 36 e 72 horas e normalização entre 5 e 14 dias. Apresentam a mesma sensibilidade diagnóstica da CK-MB em até 48 horas após o infarto agudo do miocárdio, mas em portadores de doenças que diminuem a especificidade da CK-MB elas são indispensáveis(32).
Os primeiros testes de cTnT apresentavam reação cruzada com a TnT muscular esquelética, resultando falsos positivos em portadores de doença muscular crônica e em portadores de insuficiência renal crônica. A introdução dos testes de terceira geração melhorou sua especificidade e essa limitação foi resolvida. Atualmente existe somente um teste de cTnT disponível no comércio, decorrente da patente comercial.
Para a cTnI, estão disponíveis cerca de 16 testes, o que tem causado certa confusão. São compostos por diferentes anticorpos, que reconhecem diferentes epítopos, tornando-os diferentes entre si. Possuem diferentes coeficientes de variação e seus níveis de referência chegam a variar até vinte vezes entre si. Por esse motivo, sua padronização já está sendo realizada pela American Association of Clinical Chemistry. Embora considerada específica para o miocárdio, foram publicados resultados falsos positivos decorrentes da presença de fibrina no soro, da presença de anticorpos heterofílicos e da reação cruzada com anticorpos humanos(31).
Recentemente, demonstrou-se a ocorrência de diminuição dos níveis da cTnI quando a coleta é realizada em tubo com ácido etilenodiaminotetracético (EDTA), pois o EDTA desfaz o complexo IC, influindo no resultado dos testes que utilizam anticorpos para esse complexo binário. A presença de heparina no tubo de coleta também diminui, em até 30%, tanto os níveis da cTnI como da cTnT, isso porque a heparina liga-se à molécula de ambas as troponinas e diminui sua reatividade(33).
O papel das troponinas I e T na estratificação de risco em pacientes com síndrome coronariana aguda está bem estabelecido, independentemente da troponina utilizada, na presença ou não de supradesnivelamento do segmento ST(7, 34-38). Convém salientar que essas troponinas fornecem informação prognóstica acima daquela fornecida pela história clínica, pelas alterações eletrocardiográficas e pelo teste ergométrico na alta hospitalar(38). Estudos que avaliaram a utilização dos bloqueadores dos receptores IIb/IIIa e da heparina de baixo peso molecular, em portadores de síndrome coronariana aguda, demonstraram que os pacientes com troponina positiva que receberam essas medicações obtiveram benefícios significativos, enquanto os pacientes com troponina negativa não apesentaram benefícios(9, 38). Recentemente, a publicação de um estudo que comparou a estratégia invasiva com a conservadora, em pacientes com síndrome isquêmica aguda, demonstrou benefício da estratégia invasiva somente nos portadores de troponina T positiva, correspondendo a 54% da população estudada(39).
Foi proposta, recentemente, uma subdivisão na classe IIIB da classificação de Braunwald para angina instável, em classe IIIB com troponina positiva e classe IIIB com troponina negativa. O risco de infarto agudo do miocárdio não-fatal e de óbito nos portadores de troponina positiva dessa classe é de 5%, 15% a 20% e 25% em 24 horas, 30 dias e 180 dias de seguimento, respectivamente, comparativamente a 1%, 2% e 5% naqueles com troponina negativa nos mesmos períodos(40). Vale lembrar que as troponinas não apresentam valor prognóstico em pacientes com angina pós-infarto classe IIIC de Braunwald, as quais mantêm-se elevadas por um período de 5 a 14 dias após o episódio agudo. Essa elevação por período mais prolongado limita sua utilização para diagnóstico de reinfarto. A troponina negativa, embora não afaste a presença de lesão arterial coronariana, podendo ser encontrada lesão significativa em até 30% desses pacientes, indica bom prognóstico a curto e médio prazos, permitindo a avaliação ambulatorial desses pacientes.
Qualquer lesão miocárdica, independentemente da causa desencadeante, isquêmica, tóxica ou inflamatória, pode elevar os níveis sanguíneos de troponina, e essas lesões estão sempre relacionadas a pior prognóstico.
Liberação dos marcadores de lesão miocárdica reflete lesão reversível ou irreversível?
Está sendo discutido, atualmente, se a elevação dos níveis sanguíneos dos diferentes marcadores ocorre na presença de lesão reversível ou não dos miócitos. Uma publicação recente demonstrou que a liberação da CK reflete lesão irreversível. A isquemia provocada pela oclusão arterial coronariana durante 20 minutos apresentou elevação dos níveis sanguíneos da CK atividade, com necrose miocárdica comprovada pela microscopia eletrônica. Em contraste, a isquemia durante 10 minutos, com alterações eletrocardiográficas compatíveis com isquemia grave, não apresentou alteração dos níveis de CK(41).
Em relação às troponinas, por causa de sua presença citoplasmática e de seu baixo peso molecular, questiona-se se sua liberação é secundária à lesão celular irreversível, o que é provável. Isso porque, embora tenham peso molecular menor, as troponinas atingem a circulação em tempo semelhante à CK-MB, pois são liberadas em complexo TIC, com peso molecular similar. Além disso, 95% a 97% fazem parte do aparato celular e sua degradação é mais específica para lesão irreversível que os marcadores existentes no citoplasma celular. Estudo utilizando estimulação com marcapasso e coleta de amostra em seio coronário não demonstrou alterações de seus níveis em resposta à isquemia(42, 43). A confirmação definitiva da presença de lesão irreversível ou não dos miócitos deverá ser obtida pelos estudos que estão utilizando anticorpos anti cTnI, marcados com radioisótopos que se ligarão à cTnI remanescentes nas miofibrilas dos miócitos. Do ponto de vista prático, independentemente da presença de lesão irreversível ou não, níveis alterados de troponina estão diretamente relacionados a pior prognóstico.
TESTES À BEIRA DO LEITO
O racional para a utilização de testes à beira do leito é a rápida obtenção do resultado, eliminando a entrega de material no laboratório central e sua centrifugação. As avaliações clínicas e laboratoriais demonstraram que esses testes são acurados e equivalentes aos exames realizados no laboratório central. Um estudo randomizado(10) comparando os dois tipos de testes demonstrou que o tempo necessário para a obtenção dos resultados foi de 20 minutos para o teste à beira do leito e de 72 minutos para os exames realizados no laboratório central (p = 0,0001). A acurácia tanto clínica como analítica foi equivalente entre os dois grupos. Testes à beira do leito com CK-MB, cTnT, cTnI e mioglobina estão, hoje, disponíveis no mercado, mas ainda com elevado custo em nosso meio. A utilização desses testes depende da necessidade e da habilidade com que se consegue o resultado de um teste no laboratório central. Se o tempo para a realização do exame, no laboratório central, for superior a 60 minutos, está indicada a utilização de um teste à beira do leito.
PROPOSIÇÃO DE REDEFINIÇÃO DOS CRITÉRIOS DIAGNÓSTICOS DE INFARTO AGUDO DO MIOCÁRDIO
Os critérios de infarto agudo do miocárdio foram estabelecidos em 1979, quando o melhor marcador de lesão miocárdica era a CK-MB atividade, em relação a creatina cinase, aspartato aminotransferase e desidrogenase láctica, sensíveis mas não específicas. Com a utilização de marcadores mais sensíveis e mais específicos, como a CK-MB massa e as troponinas, foi demonstrado que os marcadores protéicos apresentavam elevação de seus níveis mesmo na ausência dos critérios de infarto agudo do miocárdio com a CK-MB atividade.
Em 1999, a "International Federation of Clinical Chemistry" (IFCC)(44) e a "National Academy of Clinical Biochemistry" (NACB)(45) publicaram suas recomendações para a utilização dos marcadores bioquímicos de lesão miocárdica em pacientes com síndrome coronariana aguda. Foi sugerido o emprego de dois níveis de referência, um para diagnóstico de infarto agudo do miocárdio e outro para diagnóstico de lesão miocárdica mínima, mas ressaltaram a necessidade de reavaliação dos critérios de infarto agudo do miocárdio da Organização Mundial da Saúde.
Em agosto de 2000, foi publicada uma proposta de redefinição do infarto agudo do miocárdio(46). O documento baseou-se na capacidade das novas técnicas em diagnosticar pequenas áreas de necrose no miocárdio, menores que um grama, e do consenso de que qualquer área de lesão miocárdica secundária à isquemia deve ser considerada infarto do miocárdio.
Nessa proposta, a elevação dos níveis de troponina acima do percentil 99o de um grupo controle, em até 24 horas do início dos sintomas, seria considerado infarto agudo do miocárdio. Na ausência de troponina, a elevação dos níveis de CK-MB massa em pelo menos duas medidas sucessivas acima do percentil 99o ou ao dobro em uma única medida também deveria ser considerada infarto agudo do miocárdio. Na ausência da CK-MB massa, a CK-MB atividade pode substituí-la. A CK e a CK-B poderiam ser utilizadas como exceção, sempre considerando-se o dobro de seu valor de referência.
Nos conceitos atuais, dois pacientes com síndrome coronariana aguda e níveis de troponina igualmente elevados, um com CK-MB com o dobro de seu valor de referência e outro com níveis normais ou pouco alterados, terão o diagnóstico de infarto agudo do miocárdio e angina instável, respectivamente. O prognóstico a curto e médio prazos desses pacientes, porém, será semelhante, o que torna os critérios da Organização Mundial da Saúde irrelevantes.
Adotando-se os critérios de redefinição, ambos os pacientes receberiam o diagnóstico de infarto agudo do miocárdio com um mesmo prognóstico.
Existe certa relutância em aceitar os novos critérios: evolui-se nos marcadores de lesão miocárdica, mas não se evolui nos conceitos. A principal limitação em relação à adoção desses novos critérios seria o impacto social e psicológico causado por um número maior de diagnósticos de infarto.
MARCADORES BIOQUÍMICOS DE LESÃO MIOCÁRDICA E REPERFUSÃO CORONARIANA
O tempo de aparecimento de um marcador de lesão miocárdica na circulação sanguínea após sua liberação pelo miocárdio lesado depende da perfusão na área de infarto. A reperfusão coronariana causa elevação precoce e pico maior do marcador. Após a ocorrência do pico, entretanto, não há diferença em relação ao tempo de eliminação entre pacientes reperfundidos com sucesso ou não.
A presença ou não de reperfusão pode ser estabelecida: a) pelo aumento abstrato da concentração; b) pela alteração absoluta da concentração no decorrido tempo; e c) pela razão de concentração entre dois pontos.
A análise do pico precoce da curva enzimática da CK-MB atividade para avaliar o sucesso da terapia fibrinolítica está sendo abandonada. A confirmação do sucesso ou do insucesso terapêutico só é obtida após doze horas de monitorização, tempo que não permite medida de salvamento.
A razão da concentração da CK-MB com medida antes e 120 minutos depois da terapia fibrinolítica de 2,2 vezes para o infarto inferior e de 2,5 vezes para o anterior em 120 minutos apresenta sensibilidade de 85% e especificidade de 100% pela detecção da reperfusão(12). A dosagem com intervalo de 60 minutos não permite esse diagnóstico.
Para a mioglobina, essa razão superior a 4,6 vezes, medida antes e 90 minutos depois do início do tratamento, apresenta sensibilidade de 85% e especificidade de 100%.
Para a troponina I, essa razão é maior que 6, com sensibilidade de 86% e especificidade de 100%. Para a troponina T, essa razão deve ser maior que 6,8, com sensibilidade de 89% e especificidade de 83%.
O aumento da concentração de qualquer desses marcadores, com 90 minutos para mioglobina e 120 minutos para CK-MB, troponina I e T após início da terapia fibrinolítica, possibilita diagnóstico seguro de reperfusão à beira do leito(47).
RECOMENDAÇÕES PARA A UTILIZAÇÃO DOS MARCADORES BIOQUÍMICOS DE LESÃO MIOCÁRDICA
Mioglobinas
Marcador precoce, não é específico para lesão miocárdica e não auxilia na triagem de pacientes sem supradesnivelamento do segmento ST. No momento, sua maior indicação seria para avaliação da reperfusão coronariana após terapia trombolítica e em pacientes com supradesnivelamento do segmento ST.
CK-MB
Deve-se usar, preferencialmente, a CK-MB massa, por ser mais precoce, sensível e específica que a CK-MB atividade. Possui 100% de sensibilidade após doze horas do início dos sintomas. Possui valor prognóstico, quando positiva, em pacientes sem supradesnivelamento do segmento ST.
Troponina T ou I
É positiva em cerca de 20% a 30% dos pacientes com CK-MB negativa. Seu emprego é imprescindível em pacientes que apresentam doenças que limitem o uso da CK-MB e na presença de CK-MB negativa. Possui sensibilidade de 100% após 12 horas do início dos sintomas. Uma dosagem única positiva é suficiente para indicar pior prognóstico.
REFERÊNCIAS
1. Gibler WB, Young GP, Hedges JR, Lewis LM, Smith MS, Carleton SC, et al. Acute myocardial infarction in chest pain patients with nondiagnostic ECGs: serial CK-MB sampling in the emergency department. Ann Emerg Med 1992;21(5):504-12.
2. Wu AHB. Introduction to coronary artery disease (CAD) and biochemical markers. In: Wu AHB, ed. Cardiac Markers. New Jersey: Human Press; 1998. p.3-20.
3. Wu AHB. Biochemical markers of cardiac damage: from traditional enzymes to cardiac-specific proteins. Scand J Clin Lab Invest 1999;59(suppl 230):74-82.
4. Plebani M, Zaninotto M. Diagnostic strategies in myocardial infarction using myoglobin measurement. Eur Heart J 1998;19(suppl N):12-5.
5. Gillum RF, Fortmann SP, Prineas RJ, Kottke TE. International diagnosis criteria for acute myocardial infarction and acute stroke. Am Heart J 1984;108(1):150-8.
6. Hamm CW, Goldmann BU, Heeschen C, Kreymann G, Berger J, Meinertz T. Emergency room triage of patients with acute chest pain by means of rapid testing for cardiac troponin T or troponin I. N Engl J Med 1997;337 (23):1648-53.
7. Ohman EM, Armstrong PW, Christenson RH, Granger CB, Katus HA, Hamm CW, et al., for the GUSTO II-a Investigators. Cardiac troponin T levels for risk stratification in acute myocardial ischemia. N Engl J Med 1996;335(18): 1333-41.
8. Christenson RH, Azzazy HME. Biochemical markers of the acute coronary syndromes. Clin Chem 1998;44(Suppl B):1855-64.
9. Lindahl B. Therapeutic implications of the use of cardiac markers in acute coronary syndromes. Scand J Lab Invest 1999;59(Suppl 230): 43-9.
10. Collinson PO. The need for a point of care testing: an evidence-based appraisal. Scand J Clin Lab Invest 1999;59(Suppl 230):67-73.
11. Wu AHB. Creatine kinase, isoenzymes, and variants. In: WU AHB, ed. Cardiac markers. New Jersey: Human Press; 1998. pp.113-25.
12. Adams III JE. Clinical application of markers of cardiac injury: basic concepts and new considerations. Clin Chem Acta 1999;284:127-34.
13. El Allaf M, Chapelle J, El Allaf D, Adam A, Faymonville M, Laurent P, et al. Differentiating muscle damage from myocardial injury by means of the serum creatine kinase (CK) isoenzyme MB mass measurement/total CK activity ratio. Clin Chem 1986;32(2):291-5.
14. Medeiros LJ, Greco FA, Walsh D, Gerson B. Macro creatine kinase type 1 with electrophoretic mobility identical to that of the MB isoenzyme. Clin Chem 1985;31(8):1393-6.
15. Stein W, Bohner J, Bahlinger M. Analytical patterns and biochemical properties of macro creatine kinase type 2. Clin Chem 1985;31 (12):1952-8.
16. Wu AHB. Creatine kinase isoforms in ischemic heart disease. Clin Chem 1989;35(1):7-13.
17. Green SF. CK isoforms. In: Wu AHB, ed. Cardiac Markers. New Jersey: Human Press; 1998. pp.159-70.
18. Christenson RM, Ohman EM, Clemensen P. Characteristics of CK-MB and MB isoforms in serum after reperfusion in acute myocardial infarction. Clin Chem 1989;35:2179-85.
19. Adams III JE, Abendscchein DR, Jaffe AS. Biochemical markers of myocardial injury. Is MB creatine kinase the choice for the 1990s? Circulation 1993;88(2):750-63.
20. Apple FS. Acute myocardial infarction and coronary reperfusion serum cardiac markers for the 1990s. Clin Chem 1992;97(2):217-26.
21. Wu AHB, Lane PL. Metaanalysis in clinical chemistry: validation of cardiac troponin T as a marker for ischemic heart diseases. Clin Chem 1995;41(8):1228-33.
22. Ravkilde J. Prognostic value of biochemical markers in ischaemic heart disease. In: Kaski JC, Holt DW, ed. Myocardial damage early detection by novel biochemical markers. Boston: Kluwer Academic Publishers; 1998. pp.111-25.
23. Alexander JH, Sparapani RA, Mahaffey KW, Deckers JW, Newby LK, Ohman EM, et al., for the PURSUIT Steering Committee. Association between minor elevations of creatine kinase-MB level and mortality in patients with acute coronary syndromes without ST-segment elevation. JAMA 2000;283(3):347-53.
24. Mair J. Myoglobin. In: Kaski JC, Holt DW, ed. Myocardial Damage. Early detection by novel biochemical markers. London: Kluwer Academic Publishers; 1998. pp.53-9.
25. Montague C, Kircher T. Myoglobin in the early evaluation of acute chest pain. Am J Clin Pathol 1995;104(4):472-6.
26. Winter RJ, Lijmer JG, Koster RW, Sanders GT. Diagnostic accuracy of myoglobin concentration for the early diagnosis of acute myocardial infarction. Ann Emerg Med 2000;35(2):113-20.
27. Vaidya HC, Vaananen HK. Myoglobin and carbonic anhydrase III. In: Wu AHB, ed. Cardiac Markers. New Jersey: Human Press; 1998. pp.103-12.
28. Vuori J, Syrjälä H, Väänänen HK. Myoglobin/carbonic anhydrase III ratio: highly specific and sensitive early indicator for myocardial damage in acute myocardial infarction. Clin Chem 1996;42(1):107-9.
29. Kontos MC, Anderson FP, Hanbury CM, Roberts CS, Miller WG, Jesse RL. Use of the combination of myoglobin and CK-MB mass for the rapid diagnosis of acute myocardial infarction. Am J Emerg Med 1997;15(1):14-9.
30. Apple FS. Cardiac troponin I. In: Wu AHB, ed. Cardiac Markers. New Jersey: Human Press; 1998. pp.229-43.
31. Jaffe AS, Ravkilde J, Roberts R, Naslund U, Apple FS, Galvani H. et al. It's time for a change to a troponin standard. Circulation 2000; 102:1216-20.
32. Garg UC, Austin G, Barnes C, Hamilton M. Increased concentrations of cardiac troponin I are equivalent to increases cardiac troponin T in identifying chest pain patients at short-term risk of myocardial infarction. Clin Chem 1998;44(8):1785-9.
33. Stiegler M, Fischer Y, Vazquez JF, Graf Y, Filzmaier K, Fausten B, et al. Lower cardiac troponin T and I results in heparin plasma than in serum. Clin Chem 2000;46(9):1338-44.
34. Antman EM, Tanasijevic MJ, Thompson B, Schactman M, McCabe CH, Cannon CP, et al. Cardiac-specific troponin levels to predict the risk of mortality in patients with acute coronary syndromes. N Engl J Med 1996;35 (18):1342-89.
35. Christenson RH, Duh S, Newby LK, Ohman EM, Califf RM, Granger CB, et al., for the GUSTO II-a Investigators. Cardiac troponin T and cardiac troponin I: relative values in short-term risk stratification of patients with acute coronary syndromes. Clin Chem 1998; 44(3):494-501.
36. Olatidoye AG, Wu AHB, Feng Y, Waters D. Prognostic role of troponin T versus troponin I in unstable angina pectoris for cardiac events with meta-analysis comparing published studies. Am J Cardiol 1998;81:1405-10.
37. Stubbs P. The cardiac troponins: uses in routine clinical practice. Eur Heart J 1998;19(Suppl N):59-63.
38. Bertrand ME, Simoons ML, Fox KAA, Wallentin LC, Hamm CW, McFadden E, et al. Management of acute coronary syndromes: acute coronary syndromes without persistent ST segment elevation: recommendations of Task Force of the European Society of Cardiology. Eur Heart J 2000;21(17):1406-32.
39. Cannon CP, Weintraub WS, Demopoulos LA, Vicari R, Frey MJ, Nasser L, et al. For the TACTICS investigators. Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitors tirofiban. N Engl J Med 2001;344(25):1879-87.
40. Hamm CW, Braunwald E. A classification of unstable angina revisited. Circulation 2000;102:118-22.
41. Ishikawa Y, Saffitz JE, Mealman TL, Grace AM, Roberts R. Reversible myocardial ischemic injury is not associated with increased creatine kinase activity in plasma. Clin Chem 1997;43(3):467-75.
42. Wu AHB, Ford L. Release of cardiac troponin in acute coronary syndromes: ischemia or necrosis? Clin Chem Acta 1999;284:161-74.
43. Haider KH, Stimson WH. Cardiac myofibrillar proteins: biochemical markers to estimate myocardial injury. Mol Cell Biochem 1999; 194:31-9.
44. Panteghini M, Apple FS, Christenson RH, Dati F, Mair J, Wu AH. Proposals from IFCC Committee on standardization of markers of cardiac damage (C-SMCD): recommendations on use of biochemical markers of cardiac damage in acute coronary syndromes. Scand J Clin Lab Invest 1999;59(Suppl 230): 103-12.
45. Wu AHB, Apple FS, Gibler WB, Jesse RL, Warshaw MM, Valdes R. National academy of clinical biochemistry standards of laboratory practice: recommendations for the use of cardiac markers in coronary artery diseases. Clin Chem 1999;45(7):1104-21.
46. The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined — A consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. Eur Heart J 2000;21:1502-13.
47. Apple FS. Value of soluble markers in the diagnosis of reperfusion after
thrombolisys. In: Kaski JC, Holt SW, ed. Myocardial damage early detection by
novel biochemical markers. London: Kluwer Academic Publishers; 1998. pp.149-57.