QUADRO CLÍNICO E CLASSIFICAÇÃO DAS DISSECÇÕES AÓRTICAS
Disciplina de Cardiologia — Escola Paulista de Medicina — Universidade
Federal de São Paulo
Endereço para correspondência:
Rua Napoleão de Barros, 715 — 10o andar — CEP 04024-002 — São Paulo — SP
A dissecção aguda da aorta é um evento clínico infreqüente, embora seja de gravidade ímpar por suas potenciais conseqüências desastrosas. A mortalidade inicial é estimada em 1% por hora se não tratada adequadamente; hoje, porém, a sobrevida pode ser muito melhor que há poucos anos, desde que haja diagnóstico adequado, instituição de terapêutica clínica apropriada e conduta subseqüente dimensionada para atender as características de cada caso. Para isso, é muito importante uma definição imediata: se existe mesmo dissecção; onde se origina; e se há envolvimento de outras áreas ou órgãos com potencial de isquemia, ruptura ou falência a curto prazo.
Embora dentro do contexto de atendimento em pronto-socorro geral ou cardiológico seja um diagnóstico incomum, a dissecção aguda da aorta é a mais grave das doenças que podem envolver a aorta(1, 2). A suspeita diagnóstica é feita em apenas 50% a 70% dos casos, aproximadamente, após o início dos sintomas; a avaliação feita por meio de estudos "post mortem" têm demonstrado que, em uma proporção que varia de um terço a dois terços dos casos, não há diagnóstico em vida dos pacientes que tiveram dissecção aórtica(3, 4). A relativamente infreqüente ocorrência de dissecção e sua alta mortalidade inicial fazem com que para essa doença, que possui evolução tempo-dependente, a precocidade do diagnóstico seja a chave para que os pacientes acometidos tenham maior chance de sobrevida.
HISTÓRICO
A dissecção da aorta foi mencionada por Vesalius e depois por Nichols, que fez o diagnóstico na avaliação "post mortem" do rei Jorge II da Inglaterra. Morgagni descreveu, posteriormente, os achados de um paciente com tamponamento cardíaco secundário a ruptura da aorta e Laennec utilizou, em 1826, o termo aneurisma dissecante da aorta pela primeira vez (apud Levinson e colaboradores(5) e Anagnostopoulos e colaboradores(6)). Atualmente o termo dissecção de aorta é preferido, já que em muitas ocasiões a dissecção não se associa a um aneurisma exuberante ou evidente. Nos últimos anos, com o aprimoramento das técnicas de imagem, variantes com extensão menor que na dissecção clássica têm sido descritas, sendo caracterizadas com os nomes de hematoma intramural de aorta e úlcera penetrante de aorta(7, 8). Apesar dessa aparente melhora diagnóstica e do "aumento" relativo do número de casos, é fácil verificar que ainda existe grande contingente de casos sem diagnóstico: se o número de casos novos de dissecção é de 5/100.000 pessoas/ano(9) somente na cidade de São Paulo, deveríamos ter 500 novos casos/ano; mesmo somando a casuística de todos os centros terciários da cidade, fica-se distante desse número. Por muitas décadas a dissecção de aorta foi, de forma geral, praticamente sempre fatal; porém, nas últimas décadas, o prognóstico e as perspectivas futuras melhoraram muito, com os diagnósticos feitos mais precocemente, com o desenvolvimento de técnicas cirúrgicas que substituem a área afetada (especialmente a partir das proposições de DeBakey, Cooley e
Crawford) e, mais recentemente, com a utilização de stents percutâneos na aorta.(10-12) A utilização de betabloqueadores nessa entidade, além de proporcionar controle imediato e rápido da pressão arterial com a utilização de medicamentos tipo nitroprussiato, envolvendo, portanto, controle permanente e rígido da pressão arterial, tem sido essencial na fase aguda e, posteriormente, na evolução, para impedir ou retardar a expansão da aorta ou a ocorrência de novas dissecções(13).
ETIOLOGIA
Existem vários fatores de risco bem conhecidos e relacionados de forma
evidente com o desenvolvimento de quadros de dissecção da aorta. Existe maior
ocorrência de dissecção em indivíduos do sexo masculino com mais de 60 anos de
idade. Embora isso também ocorra em nossa experiência, diferentemente de outras
séries encontramos distribuição relativamente uniforme de casos ao longo de
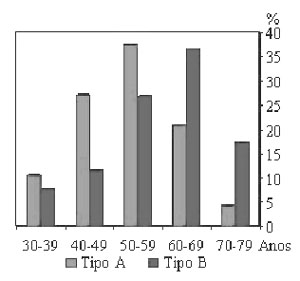
outras décadas (Fig. 1). Pessoas jovens com doenças do tecido conectivo, como
síndromes de Marfan e Ehler Danlos, bem como pacientes com síndromes de Turner
ou Noonan ou com arterite de células gigantes, apresentam a doença com mais
freqüência. Outras doenças que envolvem a aorta também podem estar relacionadas
com dissecção, como presença de coarctação da aorta e válvula aórtica bicúspide.
É extremamente freqüente a associação com hipertensão arterial sistêmica nos
pacientes que desenvolvem dissecção da aorta, o que ocorre, na maioria das
séries, em uma faixa de 80% a 90%. Outros fatores que podem estar relacionados à
ocorrência de dissecção de aorta envolvem fatores iatrogênicos, como os
relacionados a cateterismo cardíaco, balão intra-aórtico e manipulação cirúrgica
da aorta durante cirurgias cardíacas. Existem relatos, também, de dissecção em
usuários de cocaína ou pessoas que tiveram trauma torácico não-penetrante.
Gestantes no último trimestre de gravidez, hipertensas e, especialmente, se
portadoras de síndrome de Marfan também são mais suscetíveis ao desenvolvimento
de dissecções da aorta(2, 14, 15).
 |
| Figura 1. Prevalência de dissecção aórtica, analisada por décadas, em 100 casos consecutivos (48 tipo A, 52 tipo B) da Escola Paulista de Medicina no período de 1994 a 1997. O tipo A é mais freqüente nas faixas mais jovens (39 a 59 anos) e o tipo B, nas faixas acima de 60 anos(15). |
Mesmo em séries de autópsias, muitas vezes não se consegue identificar laceração da íntima; portanto, em uma minoria de casos, a hemorragia da média parece ser a causa primária da dissecção. Para alguns autores, isso ocorre em até 13% dos casos(16). Hoje poderia haver um questionamento de que esses casos refletem, na verdade, a presença de hematoma intramural e não, necessariamente, de dissecção da aorta com lesão intimal.
CLASSIFICAÇÃO DAS DISSECÇÕES AÓRTICAS
Um raciocínio objetivo e feliz, orientado para resolução do problema, fez com
que duas excelentes propostas de classificação das dissecções da aorta fossem
desenvolvidas em um período relativamente curto, observando que a maioria das
dissecções ou se origina logo acima da válvula aórtica ou logo após a artéria
subclávia esquerda. Segundo a classificação de DeBakey(17) em
dissecção dos tipos I, II e III, no tipo I o local de origem da dissecção se
propagava desde a aorta ascendente até, no mínimo, o arco aórtico e, muito
freqüentemente, para toda a aorta descendente; o tipo II correspondia a
dissecções que se originavam e se limitavam apenas à aorta ascendente; e o tipo
III corresponderia aos casos cuja dissecção se originava na aorta descendente e
se propagava distalmente na aorta toracoabdominal. A proposição de Daly(18),
ou classificação de Stanford, chama as dissecções que envolvem a aorta
ascendente de tipo A (compreendendo, portanto, os tipos I e II de DeBakey), e de
tipo B todas as dissecções que não comprometem a aorta ascendente. Nesta última
classificação, portanto, uma dissecção de aorta que se inicia após a subclávia
esquerda (e que seria, portanto, do tipo B), caso apresente dissecção
retrógrada, com comprometimento da aorta ascendente, passa a ser chamada de
dissecção tipo A e não mais tipo B. Essa classificação passou a ser mais
utilizada nos últimos anos por correlacionar, de forma objetiva, o prognóstico
com o local da dissecção (as dissecções de aorta ascendente são muito mais
graves que as de aorta descendente, a tal ponto que dissecções tipo A têm
indicação cirúrgica imediata, praticamente sem controvérsias na literatura).
Outro modo de classificação, apenas descritivo, mas também utilizado, chama de
dissecções proximais as que envolvem a aorta ascendente(19)
(compreendendo, portanto, DeBakey I e II ou Stanford A) e de distais as que
envolvem a aorta descendente (incluindo, portanto, DeBakey III ou Stanford B)
(Fig. 2).
 |
| Figura 2. Classificações mais freqüentemente utilizadas em dissecção aórtica. (Modificado da referência |
Em decorrência do acometimento extenso da aorta, com envolvimento de outras áreas ou redissecções, o acompanhamento tardio das dissecções tipo A revela sobrevida de 75% após cinco anos e de apenas 20% após quinze anos. As dissecções que envolvem a aorta ascendente correspondem a 60% a 70% dos casos; a aorta descendente, a 20%; o arco aórtico, a 10%; e a aorta abdominal, a 5%.(20)
Apesar de as classificações citadas não permitirem uma "acomodação" perfeita de casos de dissecção retrógrada, de arco (com tática e risco cirúrgico muito diferentes de um tipo A comum) e de abdome, elas persistem em uso clínico por um período superior a duas décadas exatamente por serem objetivas e práticas. Erbel e colaboradores(21) foram os últimos, em 1993, a propor uma subdivisão nas classificações já existentes, dividindo o tipo III de DeBakey ou B de Stanford, pelo eco transesofágico, em: IIIa, quando há fenda presente e dissecção anterógrada (50% de seus casos); IIIb, quando há fenda com dissecção retrógrada envolvendo só a descendente (10% de seus casos); IIIc, com presença de fenda e dissecção retrógrada atingindo o arco ou aorta ascendente (27% de seus casos); e IIId, quando a dissecção não tem comunicação do hematoma com a luz vascular (13% de sua casuística). Consultando em junho de 2001 o "The Web of Science", do The Institute of Scientific Information, usando o "Science Citation Index Expanded", no período entre 1995 e 2001, em língua inglesa, encontramos mais de 600 artigos sobre dissecção aórtica, nenhum deles propondo novas classificações para dissecção. Propostas hoje existentes referem-se a tentativas de classificação das variantes de dissecção, tipo hematoma intramural, como a proposta de Svensson e colaboradores(22), que chamam a atenção para a existência de ruptura isolada de íntima, sem hematoma na parede, após quadro clínico de dor precordial intensa. Essa variante poderia passar despercebida mesmo para semiologia sofisticada.
A classificação das dissecções aórticas, além de sua localização, também pode envolver uma escala temporal de dissecções: agudas ou crônicas. As dissecções com apresentação clínica inferior a duas semanas são chamadas de agudas, enquanto as dissecções com duas semanas ou mais são definidas como crônicas; isso tem importância prática porque a curva de mortalidade já se estabilizou após duas semanas, ou seja, a maior mortalidade já ocorreu; assim, uma série clínica ou cirúrgica composta de muitos casos crônicos fatalmente, só por isso, já terá melhor prognóstico que séries compostas predominantemente de casos agudos. Habitualmente os casos agudos correspondem a 70% a 80% das séries maiores. Na fase crônica, o risco de óbito é de 5% ao mês no primeiro ano e de 1% ao mês entre o primeiro e o terceiro anos(23).
MANIFESTAÇÕES CLÍNICAS
Sintomas
As manifestações clínicas de dissecção da aorta envolvem grande diversidade de apresentação, com aspectos polimórficos que contribuem, à primeira vista, para maior dificuldade diagnóstica. Esses mesmos aspectos, porém, se adequadamente explorados, ajudam no diagnóstico. Para isso, é essencial haver alto grau de suspeita clínica. Assim, a apresentação da dissecção pode lembrar insuficiência coronariana aguda, insuficiência aórtica aguda, pode ter características de isquemia vascular cerebral, mesentérica ou periférica, além de quadros que podem lembrar pericardite, embolia pulmonar, compressão de cava superior etc.(2, 15, 24). Os dados nas séries clínicas de Slater-DeSanctis, Spittel e do Registro Internacional de Dissecção Aórtica (IRAD)(25-27) são uniformes em apontar que a manifestação clínica inicial mais comum é dor torácica intensa, encontrada em até 96% dos casos. Essa dor é descrita, habitualmente, como súbita e insuportável, de intensidade máxima na apresentação inicial, muitas vezes descrita como de caráter dilacerante ou lancinante, ou como sensação de se estar sendo "rasgado", muitas vezes com transmissão para as regiões dorsal e abdominal. A presença de hipertensão arterial é extremamente freqüente, havendo hipotensão arterial ou choque apenas nos casos de grande derrame pericárdico ou tamponamento cardíaco. Os portadores de síndrome de Marfan podem ter dissecção de aorta sem apresentar quadro clínico típico, muitas vezes sem dor precordial.
A dor característica de acompanhar o caminho da aorta, isto é, passar da porção anterior do tórax para o dorso, ocorre com freqüência (embora na série do Registro Internacional(27) tenha sido infreqüente) e é uma pista importante para o diagnóstico. Em nosso material, o indivíduo com dor precordial que se inicia na parede anterior do tórax e que se irradia para o dorso tem grande chance de ter dissecção tipo A, enquanto os casos que ocorrem com dor apenas dorsal têm mais freqüentemente dissecção do tipo B.(24) Rosman e colaboradores(28), analisando 83 casos confirmados de dissecção, verificaram que a suspeita diagnóstica inicial foi de 85%(28). Quando a qualidade da história envolvendo a caracterização da dor (tipo, localização e irradiação) foi adequada e envolvia as três características descritas, o diagnóstico foi correto em 91% das vezes; quando a história tinha pior qualidade, sem avaliar todas as características da dor, o diagnóstico foi correto em apenas 45% dos casos. A associação de dor torácica anterior ou dorsal, com síncope, déficit neurológico, choque, hemoptise, diferença de pulsos e presença de insuficiência aórtica, é extremamente indicativa e suspeita para dissecção da aorta. Sintomas menos comuns na apresentação inicial incluem insuficiência cardíaca congestiva, paraplegia e morte súbita. Morte súbita é encontrada em apenas 3% a 4% dos casos, enquanto a síncope ocorre em até 12% das apresentações clínicas (em nossa experiência é bem menor, de 3% a 4%). A presença de insuficiência cardíaca congestiva quase invariavelmente aponta para o envolvimento da válvula aórtica com a presença de insuficiência aórtica importante, quase sempre induzida por desabamento do folheto valvar (que, constitucionalmente, é íntegro) ou presença de tamponamento cardíaco. É obrigatoriamente uma indicação de cirurgia de emergência. O diagnóstico diferencial entre dor precordial isquêmica e dissecção aórtica tornou-se ainda mais importante no cenário atual, em vista da terapêutica potencial com reperfusão trombolítica, que implica uma catástrofe enorme para o portador de dissecção. Felizmente o uso inapropriado de trombolítico, em casos de dissecção aórtica, é raro, embora evidentemente esses casos possam ser sub-relatados. O estudo europeu de trombólise pré-hospitalar(29) encontrou, em 2.750 pacientes, 9 casos de dissecção (0,33%) com uso incorreto de trombolítico. Em nosso meio, no ano passado, Almeida e colaboradores(30) fizeram uma análise da literatura nacional e internacional envolvendo 36 casos de trombólise inadequada na presença de dissecção aórtica. Como esperado, o uso do trombolítico foi catastrófico, com grande perda sanguínea e má evolução dos pacientes, clínicos ou cirúrgicos. Em dois terços dos casos, no entanto, o eletrocardiograma não era diagnóstico de infarto agudo do miocárdio com ST supra, o que implicaria a não-utilização inicial do fibrinolítico.
Exame físico
Embora extremamente variável, os achados de exame físico podem refletir a
localização da dissecção e sua extensão. Em algumas ocasiões, mesmo com
dissecção aórtica extensa, o exame físico pode ser normal, mas vale ressaltar
que não existe a palavra estável para dissecções agudas, que são o protótipo de
quadros dinâmicos, instáveis. A presença de hipotensão importante, que ocorre em
torno de 4% a 6% dos casos, pode significar tamponamento cardíaco, insuficiência
aórtica aguda grave, ruptura para pleura ou peritônio. No tipo A, a maior
prevalência é de pessoas com pressão normal. No tipo B, a maioria dos casos
apresenta-se hipertensa, praticamente não havendo casos de hipotensão (Fig. 3).
Os dados de exame físico mais classicamente associados à presença de dissecção
envolvem as diferenças de pulso, o sopro de insuficiência aórtica e as
manifestações neurológicas. Embora mais comuns na dissecção do tipo A que na do
tipo B, elas não são exclusivas de um único tipo. A presença de anormalidade nos
pulsos ocorre em até 50% (geralmente, 30% a 35%) dos casos de dissecção de aorta
ascendente; porém, eles podem ocorrer em menor porcentagem de casos no
envolvimento de aorta descendente. A diferença de pulsos, que pode ocorrer na
dissecção de aorta atingindo carótida, braquial ou femoral, sugere fortemente
compressão da luz vascular dessas artérias, muitas vezes com apresentação
isquêmica da área afetada. A insuficiência aórtica pode ocorrer em até 30% dos
casos, muitas vezes provocando apenas dispnéia. Quando presente em pacientes com
outros dados que indicam lesão de íntima distal, implica presença de lesão
preexistente da aorta ascendente ou da raiz da aorta, ou de dissecção
retrógrada. O sopro pode variar, mas, habitualmente, em uma situação de
insuficiência aórtica aguda, não há sinais periféricos como na insuficiência
aórtica crônica, tipo pulsos amplos e "pistol-shot". O envolvimento da válvula
aórtica pode ser de forma indireta, com perda do sistema de apoio da válvula, o
que provoca regurgitação. Manifestações neurológicas ocorrem em uma faixa de 6%
a 15% das dissecções, mas são um pouco mais freqüentes nos casos de dissecções
proximais. Acidente vascular cerebral propriamente dito ocorre em 3% a 6% das
apresentações clínicas. Quando existe comprometimento da perfusão da artéria
medular anterior, pode ocorrer paraparesia ou paraplegia. Em uma pequena
porcentagem de casos (1% a 2%), a dissecção pode envolver o óstio de uma artéria
coronária e causar infarto agudo do miocárdio, provocando muitas vezes, nesses
casos, grandes dificuldades diagnósticas e uso inadequado de trombolíticos ou de
encaminhamento para angioplastia primária. Essa ocorrência afeta muito mais
freqüentemente a coronária direita que a esquerda. A progressão da dissecção da
aorta abdominal pode causar isquemia mesentérica em 3% a 5% dos casos, e
envolvimento de artéria renal em 5% a 8% dos casos, até com desenvolvimento de
isquemia aguda ou insuficiência renal. Manifestações adicionais envolvem a
presença de derrame pleural, mais comum do lado esquerdo, e apresentações tipo
rouquidão, febre prolongada, compressão de via aérea superior e ruptura para
árvore brônquica com hemoptise. Raramente a dissecção pode apresentar intenso
hematoma com equimose de pele, como no caso com dissecção do arco aórtico
representado na Figura 4. A presença de sopro contínuo pode indicar ruptura da
dissecção para o átrio direito, o ventrículo direito ou o átrio esquerdo.
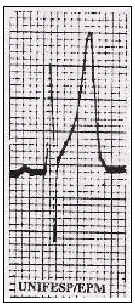 |
| Figura 3. Distribuição da pressão arterial na admissão hospitalar em 100 casos consecutivos com dissecção aórtica. Hipotensão arterial na admissão é marca registrada do tipo A, quase sempre significando grande derrame pericárdico ou tamponamento. Já os pacientes do tipo B geralmente se apresentam hipertensos(15). |
 |
 |
| Figura 4. Radiografia simples de tórax (ao lado, acima) e foto do pescoço (ao lado, abaixo) de paciente do sexo masculino, com dissecção de arco aórtico e ruptura, com extravasamento de grande hematoma causando equimose visível no pescoço sem compressão de vias aéreas. A radiografia de tórax mostra coração normal, ausência de derrame pleural e alargamento de mediastino superior direito e esquerdo. A ruptura da íntima, conforme outros subsidiários, ocorreu no arco aórtico. |
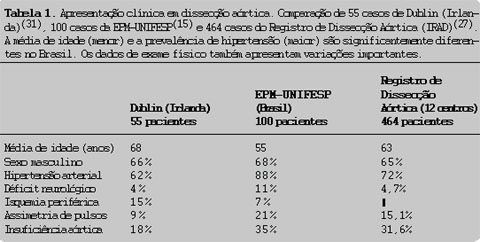
Fazendo uma comparação da apresentação clínica de dissecção aórtica em três
instâncias diferentes (Escola Paulista de Medicina, São Paulo, Brasil — 100
casos(15); Dublin, Irlanda — 55 casos(31); e Registro
Internacional de Dissecção Aórtica (IRAD)(27) — 464 casos
distribuídos entre Estados Unidos, Alemanha e Japão), verifica-se que a média de
idade da apresentação clínica no Brasil é significantemente menor (55 anos
contra 63 no IRAD e 68 em Dublin), talvez por maior falta de controle dos
hipertensos em nosso meio. A prevalência de hipertensos em nossos casos também
foi maior (80% "versus" 72% "versus" 62%, respectivamente). Além disso, há
variações notáveis na quantidade de déficits neurológicos, isquemia periférica,
alterações de pulsos e insuficiência aórtica. A prevalência de sexo masculino
entre os afetados foi similar no Brasil, na Irlanda e no IRAD (Tab. 1).
 |
O diagnóstico diferencial deve incluir infarto do miocárdio, insuficiência aórtica aguda por endocardite infecciosa, aneurismas toracoabdominais não-dissecantes, pericardites, dores de músculo esquelético ou tumor de mediastino. No tocante apenas ao diferencial da dor precordial isolada, os outros diagnósticos principais são: síndrome isquêmica aguda, tromboembolismo pulmonar, pneumotórax hipertensivo e ruptura de esôfago(32).
Em uma análise de quase 300 casos de nosso material, os parâmetros clínicos que geralmente definem dissecção tipo A são: dor torácica anterior, hipotensão arterial, tamponamento cardíaco, insuficiência cardíaca congestiva, insuficiência aórtica e assimetria de pulsos braquiais. Na dissecção tipo B, são parâmetros diagnósticos em geral: dor exclusivamente dorsal, derrame pleural esquerdo, hipertensão arterial e sexo masculino. Não definem diagnóstico de dissecção tipos A ou B os seguintes parâmetros: síndrome de Marfan, dor abdominal, síncope, paraplegia e hemoptise.(24) No registro IRAD, a radiografia simples de tórax não foi tão útil como adjunto diagnóstico, mostrando alargamento de mediastino em 60% a 70% dos casos. Em nosso material, em 166 casos consecutivos analisados, encontramos radiografia de tórax alterado (não apenas alargamento de mediastino) em 96,4% dos casos.
Finalmente, está em desenvolvimento um teste bioquímico envolvendo um
imunoensaio de anticorpo monoclonal contra cadeia pesada de miosina da célula
muscular da parede da aorta(33). Testes iniciais têm mostrado
sensibilidade de 90% e especificidade de 97% para dissecção, não havendo reação
cruzada para pacientes com síndrome isquêmica aguda. Em um futuro distante, quem
sabe, o auxílio diagnóstico dessa liberação enzimática poderá ser muito útil, no
pronto-socorro, para casos com suspeita de dissecção aórtica, assim como hoje
isso é clássico para os pacientes com infarto agudo do miocárdio.
REFERÊNCIAS
1. Hirst AE, Johns VJ, Kime SW. Dissecting aneurysm of the aorta: a review of 505 cases. Medicine 1958;37:217-79.
2. Isselbacher E. Diseases of the aorta. In: Braunwald E, Zipes D, Libby P, eds. Heart Disease. 6ed. Philadelphia: WB Saunders; 2001.
3. Doroghazi RM, Slater EE, DeSanctis RW, et al. Long-term survival of patients treated with aortic dissection. J Am Coll Cardiol 1984;3:1026-34.
4. Comino A, Ciravegna G, Mollo F. Aortic dissection at autopsy: a fifty four year survey in Torino. G Ital Cardiol 1986;16:510-5.
5. Levinson DC, Edmeades DT, Griffith GC. Dissecting aneurysm of the aorta: it's clinical, electrocardiographic and laboratory features. Circulation 1950;1:360-86.
6. Anagnostopoulos CE, Prabhakar MJS, Kittle CF. Aortic dissections and dissecting aneurysms. Am J Cardiol 1972;30:263-73.
7. Yamada T, Tada S, Harada J. Aortic dissection without intimal rupture: diagnosis with MR imaging and CT. Radiology 1988;168:347-52.
8. Stanson AW, Kazmier FJ, Hollier LH, et al. Penetrating atherosclerotic ulcers of the thoracic aorta: natural history and clinicopathological correlations. Ann Vasc Surg 1986;1:15-23.
9. Howell JM, Hedges JR. Emergency Department evaluation of the patient with chest pain. In: Gibler WB, Aufderheide TP, eds. Emergency Cardiac Care. St. Louis: Mosby Yearbook; 1994.
10. DeBakey ME, Cooley DA, Creech O. Surgical considerations of dissecting aneurysm of the aorta. Ann Surg 1955;142:586-612.
11. Crawford ES, Svensson LG, Coselli JS, et al. Surgical treatment of aneurysm and or dissection of the ascending aorta and transverse aortic arch. Factors influencing survival in 717 patients. J Thorac Cardiovasc Surg 1989;98:659-74.
12. Palma JH, Buffolo E, Carvalho AC, et al. Utilização de endoprótese auto-expansível (stent) introduzida através da artéria femoral para tratamento da dissecção de aorta descendente. Arq Bras Cardiol 1998;70:389-92.
13. Neya K, Omoto R, Kyo S, et al. Outcome of Stanford type B aortic dissection. Circulation 1992;86(suppl S):1-7.
14. Zeebregts CJ, Schepens MA, Hameeteman TM, et al. Acute aortic dissection complicating pregnancy. Ann Thorac Surg 1997;64:1345-8.
15. Lima GMP. Análise de parâmetros clínicos na admissão hospitalar em dissecções da aorta torácica: avaliação de 100 casos. São Paulo 2000. (Tese de Mestrado) Universidade Federal de São Paulo.
16. Roberts WC. Aortic dissection: anatomy, consequences and causes. Am Heart J 1981;101:195-214.
17. DeBakey ME, McCollum CH, Crawford ES, et al. Dissection and dissecting aneurysms of the aorta: 20 years follow-up of 527 patients treated surgically. Surgery 1982;92:1118-34.
18. Daly PC, Truebold HW, Stinson EB, et al. Management of acute aortic dissection. Ann Thorac Surg 1970;190:237-47.
19. Appelbaum A, Karp RB, Kirklin JW. Ascending versus descending aortic dissections. Ann Surg 1976;183:296-300.
20. Kitamura M, Hashimoto A, Akimoto T, et al. Operation for type A aortic dissection: introduction of retrograde cerebral perfusion. Ann Thorac Surg 1995;59:1195-9.
21. Erbel R, Oelert H, Meyer J, et al. Effect of medical and surgical therapy on aortic dissection evaluated by transesophageal echocardiography. Implications for prognosis and therapy. The European Cooperative Study Group on Echocardiography. Circulation 1993;87:1604-15.
22. Svensson LG, Labib SB, Eisenhauer AC, et al. Intimal tear without hematoma. An important variant of aortic dissection that can elude current imaging techniques. Circulation 1999;99:1331-6.
23. Heinemann M, Laas J, Karck M, et al. Thoracic aortic aneurysms after acute type A aortic dissection: necessity for follow-up. Ann Thorac Surg 1990;49:580-4.
24. Almeida DR, Diniz RV, Silva AC, et al. Dissecções aórticas agudas: abordagem clínica e cirúrgica. Rev Soc Cardiol Estado de São Paulo 1998;8:559-70.
25. Slater EE, De Sanctis RW. The clinical recognition of dissecting aortic aneurysm. Am J Med 1976;60:625-33.
26. Spittell PC, Spittell JA, Joyce JW, et al. Clinical features and differential diagnosis of aortic dissection: experience with 236 cases (1980 through 1990). Mayo Clin Proc 1993;68:642-51.
27. The International Registry of Acute Aortic Dissection. New insights into an old disease. JAMA 2000;283:897-903.
28. Rosman HS, Patel S, Borzak S, et al. Quality of history taking in patients with aortic dissection. Chest 1998;114:793-5.
29. The European Myocardial Infarction Group. Prehospital thrombolytic therapy in patients with suspected myocardial infarction. N Engl J Med 1993;329:383-9.
30. Almeida DR, Palma JH, Alves CR, et al. Terapêutica trombolítica na dissecção aguda de aorta. Arq Bras Cardiol 2000;74(supl I):70 (abstract).
31. Hennessy TG, Smith D, McCann HA, et al. Thoracic aortic dissection or aneurysm: clinical presentation, diagnostic imaging and initial management in a tertiary referral center. Irish J Med Sci 1996;165:259-62.
32. Clare CM, Mesquita ET. Abordagem inicial da dissecção aguda da aorta. In: Bassan R, ed. Síndrome Coronariana Aguda nas Unidades de Dor Torácica. São Paulo: Atheneu; 2000.
33. Suzuki T, Katoh H, Watanabe M, et al. A novel biochemical method for
aortic dissection — the results of a prospective study using an immunoassay of
smooth muscle heavy chain. Circulation 1996;93:1244-9.