HIPERTENSÃO PULMONAR NO TROMBOEMBOLISMO PULMONAR
Disciplina de Cardiologia - Depto. de Medicina - Escola Paulista de Medicina
- UNIFESP
Endereço para correspondência:
Rua dos Plátanos, 70 — CEP 05675-110 — São Paulo – SP
INTRODUÇÃO
A obstrução da árvore arterial dos pulmões por êmbolos pode desencadear hipertensão pulmonar tanto em condições experimentais(1) como clínicas(2, 3). Nesse contexto, torna-se necessário que se avaliem aspectos particulares da embolia pulmonar a fim de compreender as implicações médicas dessa e de outras alterações secundárias.
Estudado desde o início do século 19, o tromboembolismo pulmonar ainda apresenta pontos controversos relacionados a sua incidência, seu diagnóstico clínico-laboratorial e sua melhor terapêutica.
A verdadeira incidência da embolia dos pulmões não é conhecida. Estudos clássicos estimaram uma ocorrência de 630 mil episódios sintomáticos dessa doença nos Estados Unidos(4).Outros trabalhos consideraram o tromboembolismo a doença pulmonar aguda encontrada com maior freqüência em pacientes em tratamento hospitalar(5). Na atualidade, admite-se que esses índices devem permanecer elevados por conta da maior longevidade da população em geral(6), do uso de procedimentos diagnósticos com maior sensibilidade e especificidade(7) e do tratamento crônico mais efetivo de cardiopatias, pneumopatias e neoplasias.
Essa elevada incidência decorre do fato de a embolia pulmonar ser uma
complicação da trombose venosa profunda(8), permitindo que se
estabeleça o conceito de uma única doença denominada doença venosa
tromboembólica(9).
Etiopatogenia da doença venosa tromboembólica
A associação entre trombose venosa e embolia pulmonar foi descrita por Rudof Virchow, ao constatar que fragmentos de coágulos injetados nas veias periféricas de cães eram detectados no interior da vasculatura arterial pulmonar desses animais(10). Suas pesquisas permitiram que se estabelecesse uma tríade, que descreve um conjunto de fatores que predispõem à trombose venosa, como a estase sanguínea, a lesão endotelial e a hipercoagulabilidade do sangue(9).
Essas alterações podem aparecer isoladamente ou em associação em inúmeras condições congênitas. Destacam-se os estados de hipercoagulabilidade sanguínea e a deficiência de proteínas anticoagulantes, como as proteínas C e S, e a redução de antitrombina III e de plasminogênio(11).
Entretanto, os fatores de risco mais freqüentes são representados pelas condições adquiridas, como cirurgias do quadril e dos joelhos, próteses, fraturas de ossos longos, politrauma, imobilização, neoplasias, cirurgias gerais, e antecedentes de doença venosa tromboembólica. Devem ser considerados predispostos gestantes e puérperas, pacientes com cardiopatias ou pneumopatias prévias, idade acima de 40 anos, obesos, tabagistas, ou que utilizam pílulas anticoncepcionais(12).
A importância clínica dessas condições precipitantes fica evidente quando se observa o registro de uma incidência de 58% de trombose venosa profunda em pacientes politraumatizados(13), de 33% em doentes atendidos com doenças clínicas nas unidades de cuidados intensivos(14) e de 31% nos portadores de acidentes vasculares cerebrais agudos(15).
Em 90% dos casos, a trombose venosa inicia-se no sistema venoso profundo dos membros inferiores, nas válvulas das veias das panturrilhas, abaixo da veia poplítea(16). Em 5% a 20% dos pacientes, pode ocorrer extensão da trombose em direção proximal, comprometendo as veias femorais e ilíacas. A cauda desses trombos desprende-se, constituindo êmbolos que se fragmentam na sua passagem pelas câmaras cardíacas direitas, alojando-se preferencialmente na região basal dos pulmões, podendo desencadear, em até 50% dos casos, quadros de tromboembolismo pulmonar(17).
Alterações hemodinânicas na embolia pulmonar
A obstrução das ramificações arteriais dos pulmões desencadeia um conjunto de alterações circulatórias, que dependem do estado cardiovascular prévio do paciente, do número de recorrências de episódios tromboembólicos, da quantidade e da qualidade de êmbolos, e da capacidade de defesa do próprio paciente, determinada pela atividade de seu sistema fibrinolítico(18).
A primeira alteração detectada é um aumento da pressão arterial pulmonar secundária à elevação da resistência arteriolar nos pulmões, conseqüente, em parte, de obstrução mecânica vascular. Nos pacientes sem doença cardiovascular prévia, pode-se observar hipertensão quando ocorre obstrução de pelo menos 25% a 30% do leito arterial pulmonar(19). Comprometimento acima de 40% desencadeia repercussão sistêmica como hipotensão arterial.
Outros estudos clínicos demonstraram relação entre o número de lobos pulmonares comprometidos e o nível de hipertensão pulmonar, registrando-se níveis de 25 mmHg a 30 mmHg de pressão média no envolvimento de dois lobos e de 30 mmHg a 40 mmHg nos casos com três ou mais lobos comprometidos(20).
A elevação da resistência e da pressão arterial pulmonar também é provocada pela liberação de substâncias vasoativas oriundas da ativação plaquetária, da trombose distoproximal que se acesta sobre o êmbolo, e do comprometimento endotelial. Destacam-se, dentre elas, a serotonina, a noradrenalina, a trombina e a endotelina(11).
Outra alteração que contribui para elevar os níveis tensionais pulmonares é a hipoxemia(17), que surge na embolia pulmonar como conseqüência do aparecimento de áreas com predomínio da perfusão sobre a ventilação dos alvéolos.
A elevação da resistência pulmonar determina incremento na pós-carga imposta ao ventrículo direito, desencadeando aumentos na tensão intramural dessa cavidade e no consumo miocárdico de oxigênio(11). Em adição, o aumento da pós-carga induz à elevação transitória do resíduo diastólico final compensada, dentro de limites, pelo aumento da força de contração do coração.
Conceitos clássicos demonstram que o ventrículo direito não tem capacidade de gerar agudamente níveis pressóricos acima de 50 mmHg. Esse fato determina dilatação e descompensação dessa cavidade, seguidas de queda do débito cardíaco. A queda de débito reduz a pré-carga ao ventrículo esquerdo, com conseqüente diminuição mais ou menos acentuada da perfusão sistêmica(11).
Também pode aparecer, nessa situação, desvio do septo interventricular para a esquerda, contribuindo ainda mais para reduzir o enchimento ventricular esquerdo e o volume sistólico sistêmico. A hipotensão arterial na raiz da aorta pode reduzir a perfusão coronária, com acentuação da disfunção ventricular direita(11).
Deve-se salientar que as alterações hemodinâmicas referidas adquirem maior gravidade em cardiopatas e pneumopatas, mesmo na presença de pequenas embolias, em função da menor reserva circulatória e ventilatória que estes apresentam(17). É importante referir que os episódios embólicos agudos têm resolução quase completa na maioria dos pacientes, graças aos mecanismos intrínsecos de fibrinólise, organização e recanalização dos trombos. Evoluções desfavoráveis, cursando com hipertensão arterial pulmonar crônica, surgem em apenas 1% dos casos(8).
A ampla variação das alterações hemodinâmicas presentes na embolia pulmonar determina o aparecimento de quadros clínicos polimorfos e variáveis, que tornam o diagnóstico dessa doença difícil e muitas vezes possível apenas com a utilização de técnicas de laboratório sofisticadas.
Diagnóstico clínico
Alguns pontos devem ser lembrados quando se pretende diagnosticar tromboembolismo pulmonar. Trata-se de uma doença com maiores e menores índices de acerto diagnóstico, já que não tem apresentação clínica específica. Mesmo a doença venosa tromboembólica, geradora das embolias pulmonares, tem apresentação definida em proporções inferiores a 50%(17). Portanto, devem ser utilizados todos os recursos de anamnese e exame médico.
Assim, a valorização criteriosa dos fatores predisponentes referidos anteriormente aumenta a precisão diagnóstica.
Os sintomas mais freqüentes são a dispnéia e a dor torácica, seguidos de tosse, inchaço e dor nos membros inferiores e hemoptise(21). Alguns pacientes referem sensação indefinida de apreensão. Pode-se admitir a existência de três síndromes pulmonares decorrentes presentes na doença venosa tromboembólica aguda: dispnéia paroxística com taquipnéia; infarto pulmonar com tosse, pleurite e hemoptise; e manifestações de síncope ou choque cardiogênico(18).
Dentre os sinais mais importantes, destacam-se taquipnéia, estertores finos, taquicardia, ritmo de galope e hiperfonese da segunda bulha no foco pulmonar(21).
Fica evidente que o diagnóstico do tromboembolismo dos pulmões é difícil, já que muitos sinais e sintomas são inespecíficos e surgem, em sua plenitude, apenas nos casos onde a obstrução arterial é expressiva e se acompanha de hipertensão pulmonar.
A utilização de exames laboratoriais torna-se indispensável para fechar o diagnóstico dessa doença.
Diagnóstico laboratorial
Procedimentos usuais
Está estabelecido que os pacientes com suspeita clínica de embolia pulmonar devem ser submetidos a exames laboratoriais, visando à comprovação diagnóstica.
Deve-se solicitar, inicialmente, radiografia de tórax, que pode estar normal em inúmeros pacientes(22). Podem surgir focos de atelectasia, condensações preferencialmente basais, elevação das hemicúpulas diafragmáticas, infartos pulmonares ou derrames pleurais(17).
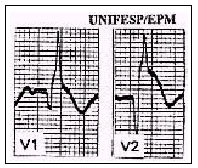
A realização de eletrocardiograma deve ser imediata. O traçado obtido pode ser normal ou apresentar alterações da repolarização ventricular ou arritmias supraventriculares, como a fibrilação atrial. Podem-se observar, especialmente nos casos com repercussão hemodinâmica expressiva, desvios do eixo elétrico para a direita além do padrão S1Q3T3(22). É útil lembrar que o traçado eletrocardiográfico permite que se estabeleça diagnóstico diferencial de outras afecções, como infarto agudo do miocárdio ou pericardite.
A determinação da gasometria arterial pode ajudar no raciocínio diagnóstico e revelar a presença de hipoxemia. Esse achado corre por conta da alteração da relação ventilação/perfusão, já que surgem áreas ventiladas mas não perfundidas e outras com perfusão aumentada em relação à ventilação(1). Entretanto, 20% dos pacientes não apresentam alterações da PaO2. Pode-se observar hipocapnia associada decorrente da taquipnéia desencadeada pela embolia(22).
Estudos ecográficos utilizando tanto o eco transtorácico(23) como o transesofágico(24) têm sido realizados com freqüência nos pacientes com suspeita clínica de tromboembolismo pulmonar. Alguns estudos demonstraram redução da função e aumento do tamanho do ventrículo direito em até 80% dos casos, relacionando diretamente disfunção a pior prognóstico(25). Outros achados incluem dilatação da artéria pulmonar, regurgitação valvar tricúspide, anomalia da movimentação do septo interventricular ou trombos endocavitários(11).
Entretanto, a sensibilidade e a especificidade desses exames são modestas, o que implica a feitura de outros exames para comprovar o diagnóstico da doença em apreço.
Para alguns autores(26), o mapeamento cintilográfico dos pulmões constitui o melhor método não-invasivo para diagnosticar embolia pulmonar. Tem sido demonstrado que a cintilografia de perfusão isolada, desde que realizada simultaneamente a radiografia de tórax, tem sensibilidade suficiente para afastar ou confirmar o diagnóstico de tromboembolismo pulmonar(27). Consideram-se positivos os mapeamentos com defeitos de perfusão múltiplos, segmentares, e que são observados em várias incidências(22).
Cintilografias negativas excluem embolia pulmonar(25). Os exames positivos são classificados como de alta, média e baixa probabilidades(26). O índice de acerto diagnóstico aumenta quando se associam as evidências clínicas, que incluem os fatores predisponentes, aos achados do cintilograma(11). As dificuldades médicas sempre surgem nos casos de média e baixa probabilidades associados a elevados índices de suspeita diagnóstica.
Nesses pacientes, está indicada a realização de angiografia pulmonar convencional para afastar ou comprovar tromboembolismo pulmonar(17, 26, 28). Consideram-se positivos os achados compatíveis com falhas de enchimento intraluminares, interrupções vasculares abruptas e impossibilidade de serem visualizadas ramificações arteriais pulmonares.
Esse exame ainda é considerado o de maior sensibilidade e especificidade para diagnosticar embolia pulmonar, permitindo obter índices de acerto diagnóstico em até 95% dos casos(17). Acompanha-se de reduzidas taxas de complicações fatais e não-fatais, que aparecem nos pacientes com hipertensão arterial pulmonar severa ou em portadores de infarto agudo do miocárdio(28).
Além da indicação já referida, o angiograma clássico deve ser obtido no tromboembolismo pulmonar sempre que houver forte suspeita clínica e presença de cardiopatia ou pneumopatia prévias, que interfiram no diagnóstico definitivo, antes das interrupções venosas ou quando houver riscos para a anticoagulação(17).
Procedimentos em evolução
Trabalhos recentes têm proposto a mensuração de D-dímeros de fibrina, com o intuito de afastar ou diagnosticar embolia pulmonar. Essas substâncias surgem no sangue como produtos da degradação da fibrina pela ação da plasmina(25). Vários métodos podem ser empregados para sua mensuração, como a técnica de ELISA ou a utilização de anticorpos monoclonais(11).
Consideram-se normais os valores inferiores a 500 ng/ml(11). Resultados nessa faixa de normalidade excluem embolia pulmonar(25, 29). Níveis acima desse valor permitem identificar, com alta sensibilidade, os pacientes com tromboembolismo pulmonar(11).
Entretanto, outros quadros de trombose intravascular, como trombose venosa profunda dos membros inferiores(30), também podem elevar os níveis de D-dímeros de fibrina, denotando a baixa especificidade desse exame(9). Em adição, existe a necessidade de padronização mais homogênea das diversas técnicas utilizadas para sua determinação(31). Portanto, a definição diagnóstica de embolia pulmonar deve ser feita avaliando-se os resultados dos D-dímeros associados a informações oriundas de outros exames, como Doppler/ultra-som das veias dos membros inferiores(29).
O estudo ultra-sonográfico do sistema venoso profundo dos membros inferiores apresenta vantagens como acurácia diagnóstica e baixo custo(9). Trata-se de exame não-invasivo, que pode ser repetido inúmeras vezes sem prejuízo para o paciente. Entretanto, pode fornecer resultados falsos negativos, principalmente quando a trombose está restrita às veias da panturrrilha(17) ou em pacientes assintomáticos(9).
Outro método de imagem sugerido para diagnosticar tromboembolismo pulmonar é a tomografia computadorizada helicoidal. As imagens tomográficas do tórax são obtidas após a injeção de 100 ml a 150 ml de contraste em veia periférica. Além de possibilitar a vizualização do próprio êmbolo, permite que se afastem outras doenças com aspectos clínicos superponíveis ao tromboembolismo pulmonar, como as dissecções aórticas agudas(31).
Dados comparando a sensibilidade e a especificidade desse procedimento com a angiografia convencional ou autópsias revelam índices de sensibilidade e especificidade para diagnosticar embolia pulmonar de 72% e 95%, respectivamente(7). Esses números tornam-se modestos quando se analisam ramos arteriais pulmonares subsegmentares, demonstrando a limitação do exame nessa circunstância(31).
Tratamento da hipertensão pulmonar no tromboembolismo pulmonar
O tratamento da hipertensão pulmonar no tromboembolismo pulmonar baseia-se em três pontos fundamentais: manter a vida do paciente por meios de suporte avançado de vida, evitar recorrências e minimizar os efeitos hemodinâmicos.
Deve-se aliviar a dor com antiinflamatórios não-esteróides, que são muito efetivos em aliviar a dor pleural, deixando-se os opiáceos para situações especiais, pois a dor promove a liberação de catecolaminas que contribuem para a elevação da resistência arterial pulmonar.
O oxigênio deve ser administrado para se manter a PaO2 acima de 60 mmHg a 70 mmHg, não somente para o transporte adequado de oxigênio aos tecidos, mas, também, para impedir a vasoconstrição pulmonar desencadeada pela hipoxia. A oxigenação é importante, e nos casos mais graves, caso não se consiga, são necessárias intubação e ventilação mecânica e, eventualmente, a manutenção de pressão positiva expiratória final.
Apesar de a pressão positiva expiratória final ter um pequeno efeito deletério no débito cardíaco, tende a aumentar a fibrinólise e a produção pulmonar de prostaglandinas vasodilatadoras, promovendo, assim, melhora das condições ventilatórias e hemodinâmicas(32).
Apesar das poucas séries demonstrando a ação de drogas vasoativas na embolia pulmonar, certos medicamentos podem melhorar o desenvolvimento do ventrículo direito. A dobutamina é a droga de escolha nos pacientes com disfunção do ventrículo direito e choque cardiogênico. É uma droga agonista beta-adrenérgica com efeito inotrópico positivo e efeitos na circulação pulmonar com discreta vasodilatação, levando à melhora da contratilidade do ventrículo direito e à diminuição da resistência vascular. A dose média deve ser, inicialmente, de 5-8 µg/kg/min(33).
O dextran é um polissacarídeo que inibe a agregação e a adesão plaquetárias e pode ser utilizado nos pacientes que necessitem de volume, principalmente naqueles com alto risco hemorrágico ou trombocitopênico. A dose inicial é de 20 ml, seguidos de infusão contínua de 20 ml/h(34).
Os inibidores da fosfodiesterase (amrinona) também apresentam efeitos inotrópicos positivos, com melhora dos níveis da pressão arterial pulmonar, porém ainda é desconhecido o real benefício em termos de prognóstico e evolução desses pacientes, além de ser uma medicação com efeitos colaterais não desprezíveis(35, 36).
Diversos medicamentos têm sido aventados para o uso na hipertensão pulmonar na embolia pulmonar, tais como vasoconstritores alfa-adrenérgicos, norepinefrina, fentolaminas, bloqueadores de canais de cálcio e diversas outras drogas, porém não se mostraram eficazes em minimizar os efeitos hemodinâmicos desencadeados pelo fenômeno tromboembólico(37).
A anticoagulação com heparina e, posteriormente, com antagonistas da vitamina K é chamada de "tratamento"; porém, na realidade, constitui a prevenção de recorrência. O risco relativo dessa recorrência é de 15:1 em relação aos pacientes que estão tomando a heparina de maneira inadequada(38).
Pacientes com função ventricular direita normal, em geral, revelam fenômenos pouco intensos e têm bom prognóstico com a utilização de heparina isoladamente(39). Em geral, é administrada na dose inicial de 80 U/kg em bolo e, a seguir, 18 U/kg/h, durante cinco a sete dias, ajustando-se de acordo com o TTPA de 1,5 a 2,5 vezes os valores normais(40).
A heparina atua primariamente por ligação à antitrombina III, uma enzima que inibe os fatores trombínicos da coagulação, tornando-a mais ativa de 100 a 1.000 vezes.
Além de prevenir a formação adicional de trombos, permite que a atividade fibrinolítica espontânea do indivíduo em provocar a lise do trombo se realize mais facilmente(41).
Antes de se iniciar a terapêutica com heparina, é preciso considerar os fatores que podem predispor a sangramentos, tais como história de hemorragias, trombocitopenias, deficiências de vitamina K e doenças concomitantes(42).
A heparina induz trombocitopenia em 3% a 4% dos pacientes no uso de sete a dez dias. É um processo auto-imune, que deve ser suspeitado quando as plaquetas caem abaixo de 50% dos valores basais ou abaixo de 100,00 por µl. Nesses casos, a heparina deve ser suspensa(43).
Existe uma série de evidências que justificam a utilização da heparina de baixo peso molecular no tratamento do tromboembolismo pulmonar. A heparina de baixo peso molecular não requer monitorização laboratorial e elimina a infusão contínua, o que leva à alta mais precoce do paciente; sua relação custo-efetividade, portanto, é melhor que a da heparina não-fracionada(44).
Existem evidências em relação à diminuição da mortalidade com a heparina de baixo peso molecular e com a heparina não-fracionada, particularmente em pacientes com neoplasias. A heparina de baixo peso molecular, porém, ainda não foi aprovada pela "Food and Drug Administration" para o tratamento do tromboembolismo pulmonar.
As intervenções que melhoram a pressão na artéria pulmonar melhoram também o prognóstico do paciente. A terapia trombolítica, ao longo do tempo, mostrou-se muito eficiente na lise do trombo, na redução da pressão em artéria pulmonar e, conseqüentemente, na melhora do desempenho do ventrículo direito. Além do efeito na lise do trombo que se alojou no pulmão, apresenta efeitos de lise no trombo residual que causou o fenômeno, prevendo, de certa forma, a recorrência. Dessa forma, a trombólise deve ser considerada nos pacientes com quadro de embolia com hipotensão arterial ou naqueles onde a pressão arterial sistêmica está normal, mas apresenta anormalidades ecocardiográficas ou clínicas de disfunção de ventrículo direito(45).
A hipotensão sistêmica, geralmente, é sinal de mau prognóstico; entretanto, o franco colapso circulatório não é comum, mesmo nos fenômenos importantes. Dessa forma, a presença de hipocinesia do ventrículo direito, mesmo na ausência de hipotensão, sugere que a terapia trombolítica deva ser instituída. As evidências em relação ao prognóstico com o uso de trombolítico, comparado com a prevenção secundária utilizando somente a heparina, estão muito bem fundamentadas, mostrando melhora acentuada com o uso do trombolítico(46).
O uso de fibrinolíticos nos últimos anos tem mostrado que são drogas
relativamente seguras, com relação custo-benefício favorável e de fácil
aplicabilidade. O conceito da necessidade de angiografia pulmonar prévia
para aplicação da terapia já está ultrapassado, podendo ser indicada com
ecocardiograma ou cintilografia pulmonar sugestiva de tromboembolismo
pulmonar. Além disso, a janela terapêutica de 5 dias se estendeu para 14
dias, sendo factível a utilização de qualquer tipo de trombolítico
disponível, por veia periférica, e podendo ficar em unidades de cuidados
intermediários.
 |
Na Tabela 1 estão apresentados os principais trombolíticos utilizados no tromboembolimo pulmonar.
As contra-indicações para trombólise, tais como doenças intracranianas, cirurgias recentes ou traumas, devem ser pesquisadas para um melhor juízo clínico, podendo esses pacientes receber outro tipo de terapêutica, minimizando, dessa forma, os sangramentos.
Entre as complicações da trombólise, a mais séria é a hemorragia cerebral, que ocorre geralmente em regiões corticais e subcorticais da substância branca, na porcentagem de 1,9%, sendo aproximadamente um terço delas fatais. Os pacientes jovens estão menos sujeitos ao risco de sangramentos, quando comparados aos idosos. E aqueles com aumento da pressão diastólica do ventrículo esquerdo apresentam maior índice de complicações hemorrágicas.
Nos pacientes em que houve falência da trombólise, ou em que havia contra-indicação para o uso do trombolítico, está indicada a embolectomia pulmonar com cateter-balão.
A embolectomia pulmonar é o procedimento que pode ser utilizado nos portadores de tromboembolismo pulmonar maciço com comprometimento hemodinâmico, e a terapêutica trombolítica está contra-indicada. Porém, esse tipo de procedimento requer equipamento sofisticado e uma equipe treinada. São necessárias esternotomia e anestesia geral, e, na maioria dos casos, os pacientes estão em condições críticas.
Já a embolectomia por cateter transvenoso oferece uma alternativa para
esses pacientes críticos. Não existem muitas contra-indicações para esse
procedimento, que não necessita de equipamento sofisticado ou anestesia
geral, e que pode ser realizado na sala de hemodinâmica. O objetivo do
procedimento é remover quantidade suficiente de trombo para restaurar o
fluxo na artéria pulmonar e assim diminuir a pressão no ventrículo direito(47).
Referências
1. Kasinski N, Afonso JE, Ferreira C, et al. Embolia pulmonar com coágulo autólogo. Estudo experimental em cães. Arq Bras Cardiol 1980;34:203-10.
2. Urokinase Pulmonary Embolism Trial — A National Cooperative Study. Circulation 1973;47(supll II): 1-108.
3. Baruzzi AC, Knobel E, Cirenza C, et al. Repercussões hemodinâmicas da terapia trombolítica no tromboembolismo pulmonar agudo. Arq Bras Cardiol 1995;64:515-20.
4. Dalen JE, Alpert JS. Natural history of pulmonary embolism. Prog Cardiovasc Dis 1975;17:259-70.
5. Wenger NK. Pulmonary embolism. Strategy for evaluation and treatment of patients at increased risk. Postgrad Med J 1988;84:107-12.
6. Silverstein MD, Heit JA, Mohr DN, et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism. Arch Intern Med 1998;158:585-93.
7. Opinions regarding the diagnosis and management of venous thromboembolic disease. ACCP Consensus Committee on Pulmonary Embolism. Chest 1998;113:499-504.
8. Moser KM, Fedullo PF. Acute and chronic pulmonary thromboembolism. In: Peacock AJ, ed. Pulmonary Circulation. London: Chapman & Hall; 1996. p.391.
9. Tapson VF. Venous thromboembolism. In: Topol EJ, ed. Textbook of Cardiovascular Medicine. New York: Lippincott-Raven; 1998. p.727.
10. Virchow R. Thrombose und Embolie, 1846-1856. Leipzig: Johann Ambrosius Barth; 1910. p.237.
11. Goldhaber S. Pulmonary embolism. In: Braunwald E, ed. Heart Disease. A Textbook of Cardiovascular Disease. Philadelphia: Saunders Company; 1997. p.1582.
12. Corris P, Ellis D, Foley N, et al. Suspected acute pulmonary embolism. A practical approach. Chest 1997;52(suppl 4):S2-S24.
13. Geerts WH, Code KI, Jay RM, et al. A prospective study of venous thromboembolism after major trauma. N Engl J Med 1994;331:1601.
14. Hirsh DR, Ingenito EP, Goldhaber S. Prevalence of deep venous thrombosis among patients in medical intensive care. JAMA 1995;274:335.
15. Turpie AGG, Gent M, Côte R, et al. A low molecular weigth heparinoid compared with unfractioned heparin in the prevention of deep vein thrombosis in patients with acute ischemic stroke: a randomized double-blind study. Ann Intern Med 1992;117:353.
16. Jeffrey PC, Immelman EJ, Banatar SR. Deep vein thrombosis and pulmonary embolism: an assessment of the accuracy of clinical diagnosis. S Afr Med J 1980;57:643-51.
17. Ryu JH, Rooke TW, Rosenow EC. Venous thromboembolism. In: Giuliani ER, Gersh BJ, ed. Mayo Clinic Practice of Cardiology. New York: Mosby; 1996. p.1837.
18. Kasinski N. Como eu trato: embolia pulmonar. Rev Soc Cardiol Estado de São Paulo 1993;3:74-81.
19. Sharma GVKK, McIntyre MM, Sasahara AA. Clinical and hemodynamic correlates in pulmonary embolism. Clin Chest Med 1984;5:421-37.
20. Sharma GVKK, McIntyre MM, Sasahara AA. Clinical and hemodynamic correlation in pulmonary embolism. In: Hyers T, ed. Clinics in Chest Medicine. Philadelphia: WB Saunders; 1984. p.121.
21. Stein PD, Terrin ML, Hales CA, et al. Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no pre-existing cardiac or pulmonary disease. Chest 1991;100:598-603.
22. Kasinski N. Tromboembolismo pulmonar. Etiopatogenia, diagnóstico e prognóstico. In: Timerman A, César LAM, ed. Manual de Cardiologia — SOCESP. São Paulo: Atheneu; 2000. p.249.
23. Perrier A, Tamm C, Unger PF, et al. Diagnostic accuracy of Doppler-echocardiography in unselected patients with suspected pulmonary embolism. Int J Cardiol 1998;65:101-9.
24. Vieillard-Baron A, Qanadi SD, Antakly Y, et al. Transesophageal echocardiography for the diagnosis of pulmonary embolism with acute cor pulmonale: a comparison with radiological procedures. Intens Care Med 1998,24:429-33.
25. Goldhaber S. Pulmonary embolism. N Engl J Med 1998;339:93-104.
26. Baker WF Jr. Diagnosis of deep vein thrombosis and pulmonary embolism. Med Clin North Am 1998;82:17-34.
27. PISA-PED Investigators. Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the Prospective Investigative Study of Acute Pulmonary Embolism Diagnosis. Am J Resp Crit Care Med 1997;154:1387-93.
28. Oudkerk M, van Beek EJ, van Putten WL, et al. Cost-effectiveness analysis of various strategies in the diagnostic management of pulmonary embolism. Arch Intern Med 1993;153:947-51.
29. Ginsberg JS, Wells PS, Kearon C, et al. Sensitivity and specificity of a rapid whole — blood assay for D-dimer in the diagnosis of pulmonary embolism. Ann Intern Med 1998;129:1006-11.
30. Ginsberg JS, Kearon C, Douketis J, et al. The use of D-dimer testing and impedance plethysmographic examination in patients with clinical indications of deep vein thrombosis. Arch Intern Med 1997;157:1077-81.
31. Woodward PK, Yusen R. Diagnosis of pulmonary embolism with spiral computed tomography and magnetic resonance imaging. Curr Opin Cardiol 1999;14:442-7.
32. Suter PM, Fairley HB, Isenberg MD. Optimum end-expiratory airway pressure in patients with acute pulmonary failure. N Engl J Med 1975;292:284-9.
33. Jardin F, Genevray B, Brun-Ney D, et al. Dobutamine: a hemodynamic evaluation in pulmonary embolism shock. Crit Care Med 1985;13:1009-12.
34. Bergquist D. Dextan. In: Goldhaber SZ, ed. Prevention of venous thromboembolism. New York: Marcel Dekker; 1993. p.167.
35. Wolfe MW, Saad RM, Spence TH. Hemodynamic effects of amrinone in a canine model of massive pulmonary embolism. Chest 1992;102:274-8.
36. Spence MT, Newton D. Pulmonary embolism: improvement in hemodynamic function with Amrinone therapy. South Med J 1989;82:1267-68.
37. Lualdi JC, Goldhaber SZ. Right ventricular dysfunction after acute pulmonary embolism: pathophysiologic factors, detection, and therapeutic implications. Am Heart J 1995;130:1276-82.
38. Wilson JR, Lampmar J. Heparin therapy. A randomized prospective study. Am Heart J 1979;97:155-8.
39. Wolfe MW, Lee RT, Feldstein ML, et al. Prognostic significance of right ventricular hypokinesis and perfusion lung scan defects in pulmonary embolism. Am Heart J 1994;127:1371-6.
40. Raschke RA, Reilly BM, Guidry JR, et al. The weight-based heparin dosing nomogram compared with a "standard care" nomogram. A randomized controlled trial. Ann Intern Med 1993;119:874-7.
41. Barrit DW, Jordan SC. Anticoagulant drugs in the treatment of pulmonary embolism: a controlled trial. Lancet 1960;1:1309-13.
42. Landefeld CS, Cook EF, Flatley M, et al. Identification and preliminary validation of predictors of major bleeding in hospitalized patients starting anticoagulant therapy. Am J Med 1987;82: 703-8.
43. Hyers TM. Venous thromboembolism. Am J Respir Crit Care Med 1999;159:1-14.
44. Hull RD, Pineo GF. Low molecular weight heparin treatment of venous thromboembolism. Prog Cardiovasc Dis 1994;37:71-8.
45. Goldhaber SZ. Contemporary pulmonary embolism thrombolysis. Int J Cardiol 1998;65:S91-S93.
46. Jerjes-Sanchez C, Ramirez-Rivera A, Garcia M, et al. Streptokinase and heparin versus heparin alone in massive pulmonary embolism: a randomized controlled trial. J Thromb Thrombolysis 1995;2: 227-9.
47. Greenfield LJ, Proctor MC. Role of catheter-embolectomy in treating
pulmonary embolism. Sem Resp Crit Care Med 1996;17:95-9.