Departamento de Cardiologia Invasiva — Instituto Dante Pazzanese de Cardiologia
Endereço para correspondência:
Av. Dr. Dante Pazzanese, 500 — Ibirapuera — CEP 04012-909 — São Paulo — SP
INTRODUÇÃO
As arritmias cardíacas são uma entidade relativamente comum no pós-operatório de cirurgia cardíaca, acometendo entre 20% e 40% dos pacientes após os mais diferentes tipos de tratamento cirúrgico(1-3). As arritmias causam prolongamento da internação hospitalar em decorrência de complicações secundárias ao distúrbio hemodinâmico, como, por exemplo, insuficiência cardíaca, choque cardiogênico ou complicações tromboembólicas nos pacientes com fibrilação atrial. Além da morbidade e da maior mortalidade, há também implicações econômicas por causa do aumento dos custos do tratamento.
São escassos os estudos controlados, com bom poder estatístico, em cujos resultados se possam estabelecer condutas na abordagem clínica de pacientes com arritmias no pós-operatório. O tratamento, na maioria das vezes, é baseado em informações obtidas de estudos pequenos e, não raramente, é alicerçado em experiência própria de cada serviço, sem a certeza de que aquela seja a melhor forma de se atuar.
Dentre as arritmias de pós-operatório de cirurgia cardíaca, a fibrilação atrial é a mais comum e a que mais preocupação traz ao clínico(1-3). Além dos riscos provocados pela freqüência cardíaca rápida, existe sempre a possibilidade de tromboembolismo periférico. O "flutter" atrial e a taquicardia atrial são menos comuns, e podem ter o mecanismo de origem similar ao da fibrilação atrial. As extra-sístoles ventriculares são muito comuns, mas, a menos que estejam associadas a episódios de taquicardia ventricular, não oferecem maior risco. A taquicardia e a fibrilação ventriculares são raras complicações de pós-operatório, e devem estar mais diretamente relacionadas com a cardiopatia subjacente (insuficiência coronariana ou valvopatia, por exemplo) que com o procedimento cirúrgico propriamente. A taquicardia juncional não-paroxística está freqüentemente associada ao pós-operatório de cardiopatias congênitas e, portanto, é mais comum em crianças.
Nesta revisão serão abordados os aspectos clínicos, o diagnóstico e o tratamento das principais taquiarritmias de pós-operatório de cirurgia cardíaca. As informações aqui apresentadas são baseadas nas publicações científicas mais recentes, destacando-se o fato de que poucos estudos dedicados a essa área especificamente estão disponíveis na atualidade.
DIAGNÓSTICO ELETROCARDIOGRÁFICO DAS ARRITMIAS CARDÍACAS NO PÓS-OPERATÓRIO
Durante a evolução do pós-operatório, nas primeiras 48 horas, o paciente encontra-se internado na unidade de recuperação ou de terapia intensiva, e, por estar monitorizado, o surgimento de uma arritmia deverá ser prontamente identificado. Entretanto, nem sempre é possível se estabelecer o diagnóstico correto por meio da análise da relação entre as ondas P e os complexos QRS pelo eletrocardiograma convencional, fato da mais alta importância para o diagnóstico preciso. A utilização de derivações eletrocardiográficas especiais, como as epicárdicas, possibilita a identificação, separadamente, dos eletrogramas atriais e ventriculares(2).
Derivações epicárdicas
O registro de derivações especiais no pós-operatório de
cirurgia cardíaca agiliza o diagnóstico e o tratamento de grande parte das
arritmias que complicam a evolução dos pacientes nesse período. O implante de
eletrodos temporários de marcapasso no epicárdio atrial e ventricular facilita
o reconhecimento e permite a abordagem precoce das arritmias mais comuns (Fig.
1).
|
|
|
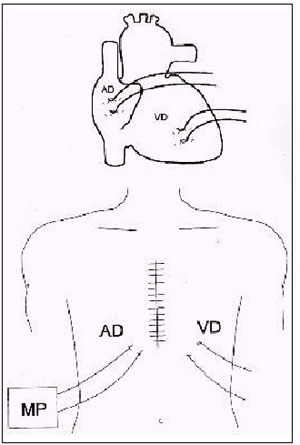
Figura 1. Na ilustração superior, esquema mostrando o posicionamento dos eletrodos epicárdicos no átrio direito e no ventrículo direito, durante o ato cirúrgico. Na ilustração inferior, os eletrodos são expostos na superfície torácica, permitindo o registro da atividade elétrica cardíaca. |
AD = átrio direito; VD = ventrículo direito; MP = marcapasso.
Os eletrodos exteriorizados devem ser devidamente isolados com pequenos tubos de borracha, para evitar contato com superfícies que possam provocar descargas elétricas que afetam o ritmo cardíaco. Além disso, não devem ter contato com líquidos que possam causar danos aos eletrodos(2, 4).
Para o registro dos eletrogramas atriais ou ventriculares, os eletrodos epicárdicos são ligados, por meio de conexões do tipo "jacaré", aos cabos correspondentes ao dos braços direito e esquerdo do sistema que registra o eletrocardiograma. Os cabos dos membros inferiores devem ser conectados de maneira convencional ao eletrocardiógrafo(2). O registro do eletrocardiograma deve ter o seletor de derivações posicionado em D1 para inscrição de eletrogramas bipolares(2, 4). Desejando-se fazer o registro unipolar, como acontece nos casos em que apenas um único fio estiver suturado ao epicárdio, os eletrodos dos membros são conectados como de rotina e o fio epicárdico é conectado ao cabo correspondente à derivação precordial (V1, por exemplo). O registro deverá ser feito no eletrocardiógrafo, com o seletor posicionado para inscrição de derivações precordiais(2, 4).
Por causa da proximidade entre os eletrodos no epicárdio
atrial, por exemplo, que estão conectados aos respectivos eletrodos dos braços
direito e esquerdo, os eletrogramas bipolares apresentam a atividade atrial de
grande amplitude e a de origem ventricular (distante dos eletrodos atriais),
de menor tamanho. Por outro lado, a derivação unipolar apresenta eletrogramas
atriais e ventriculares de grande amplitude, já que o registro será feito
entre o eletrodo posicionado no átrio (que está conectado à derivação
precordial) e a central terminal do eletrocardiógrafo, estando, portanto,
distante do coração(2, 4). Quando se pretende obter uma derivação
unipolar, é aconselhável que se faça o registro em dois canais simultâneos, um
para os eletrogramas e outro para uma derivação eletrocardiográfica
convencional. Desse modo, ter-se-á a certeza de qual eletrograma corresponde
ao QRS e qual corresponde à onda P (Fig. 2). Durante ritmo sinusal normal, por
exemplo, duas deflexões de mesma magnitude podem estar presentes, não causando
muita confusão. Em vigência de taquicardia juncional com condução retrógrada
atrial, entretanto, ficará difícil o diagnóstico diferencial com uma
taquicardia sinusal com bloqueio atrioventricular do primeiro grau, por
exemplo.
|
|
|
Figura 2. Registro simultâneo de derivação eletrocardiográfica de monitor cardíaco (canal superior) e eletrograma epicárdico bipolar do átrio direito (canal inferior). Paciente evoluindo no pós-operatório com ritmo sinusal. Observa-se que a atividade elétrica atrial é de grande amplitude, por causa da proximidade dos eletrodos com o átrio direito, e que a ventricular é pequena, em decorrência da distância daqueles eletrodos com os ventrículos. |
Para o tratamento de arritmias atriais ou ventriculares, os eletrodos epicárdicos podem ser conectados a um marcapasso artificial para se proceder à estimulação cardíaca programada. Essa técnica tem a grande vantagem da não necessidade de administração de fármacos antiarrítmicos para a reversão da arritmia. Quando aplicada corretamente, apresenta elevado índice de sucesso. Durante a estimulação, deve-se tomar o cuidado de isolar o paciente de potenciais fugas de corrente provenientes de outros aparelhos elétricos nas cercanias, para se evitar desencadeamento de fibrilação ventricular. Além disso, os ventrículos devem ser estimulados com freqüências que sejam hemodinamicamente toleradas pelo paciente. Nesse sentido, marcapassos temporários que dispõem de freqüências rápidas de estimulação para serem empregadas em arritmias atriais não devem ser utilizados para o tratamento de arritmias ventriculares, a menos que se certifique de que o seletor de freqüências rápidas não será utilizado.
Alguns estudos experimentais realizados em cães(5) e, mais recentemente, estudos clínicos realizados em humanos(6) têm demonstrado a utilidade dos eletrodos epicárdicos temporários para a cardioversão elétrica de episódios de fibrilação atrial no pós-operatório de cirurgia cardíaca. Com intensidades baixas de corrente para a cardioversão, essa técnica tem apresentado elevado índice de sucesso, com a grande vantagem de não necessitar anestesia geral ou sedação profunda(6).
IMPORTÂNCIA CLÍNICA DAS ARRITMIAS NO PÓS-OPERATÓRIO DE CIRURGIA CARDÍACA
Na dependência do tipo de arritmia, das condições clínicas do paciente, da cardiopatia subjacente e da freqüência cardíaca durante a arritmia, as alterações do ritmo cardíaco provocam repercussões variáveis sobre o débito cardíaco, consumo de oxigênio pelo miocárdio e fluxo sanguíneo coronariano. O débito cardíaco pode reduzir em presença de taquicardias rápidas (geralmente acima de 150 batimentos por minuto) por causa do encurtamento do tempo de diástole. A queda do débito é mais intensa quando há disfunção ventricular associada, dissociação atrioventricular (como nos casos de taquicardia juncional não-paroxística ou taquicardia ventricular), ausência de contração atrial (como na fibrilação atrial) e presença de regurgitação mitral (como na taquicardia ventricular).
O consumo de oxigênio miocárdico pode ser influenciado pelas variações da freqüência cardíaca e da pressão arterial. Taquicardias rápidas encurtam o tempo de diástole com conseqüente redução da perfusão miocárdica. A queda da pressão na raiz da aorta diminui a pressão de perfusão coronariana, agravando ainda mais a relação entre a oferta e o consumo de oxigênio. Nos casos de bradicardias graves, pode haver redução do fluxo sanguíneo miocárdico quando há hipotensão arterial associada.
ARRITMIAS DO PÓS-OPERATÓRIO DE CIRURGIA CARDÍACA
Fibrilação atrial
É a arritmia mais comum, ocorrendo, na maioria das vezes, nos primeiros dois ou três dias de pós-operatório. Numa análise de 570 pacientes submetidos a revascularização miocárdica, Aranki e colaboradores(7) demonstraram incidência de 33% nos pacientes operados(7). Num estudo multicêntrico envolvendo 2.417 pacientes revascularizados, Matthew e colaboradores(8) relataram incidência dessa arritmia em 27% dos casos(8).
A fibrilação atrial (Fig. 3) costuma apresentar-se na forma
de episódios transitórios repetitivos (principalmente nas primeiras 48 horas)
ou em crises de longa duração, que dificilmente revertem espontaneamente antes
da alta hospitalar (as de ocorrência tardia, > 48 horas). As repercussões
clínicas variam, particularmente, com a freqüência cardíaca e o estado da
função ventricular. Freqüências cardíacas elevadas são geralmente mal
toleradas por pacientes com disfunção ventricular, causando instabilidade
hemodinâmica e retardando a evolução pós-operatória. Em outros casos, a
arritmia instala-se sem que qualquer modificação do quadro clínico seja
observada. Definitivamente, já se demonstrou que o surgimento de fibrilação
atrial após a cirurgia prolonga o tempo de internação hospitalar(1).
|
|
|
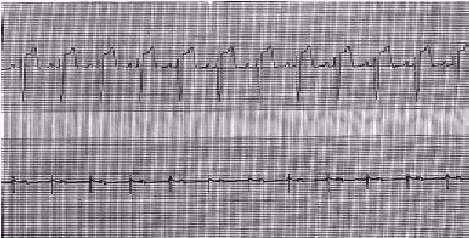
Figura 3. Derivação eletrocardiográfica obtida de monitor cardíaco (canal superior) simultaneamente ao eletrograma epicárdico bipolar do átrio direito (canal inferior) durante episódio de fibrilação atrial em pós-operatório de revascularização miocárdica. Observa-se a desorganização total da atividade elétrica atrial, característica dessa arritmia, concomitante ao registro da irregularidade do intervalo RR. |
O tromboembolismo periférico é uma complicação bem conhecida da fibrilação atrial. Em pacientes revascularizados, o risco de acidente vascular cerebral varia entre 1% e 6% dos casos(9, 10). Pacientes com déficit neurológico prévio, insuficiência cardíaca, átrios muito dilatados ou com sopro carotídeo são os que apresentam maior risco.
As causas de fibrilação atrial após cirurgia cardíaca ainda são muito discutidas, mas podem ser divididas em pré-operatórias e intra-operatórias. Dentre as primeiras, história prévia de fibrilação atrial, idade avançada, presença de valvopatia (particularmente estenose mitral), distúrbios da condução intra-atrial causadas por hipertensão arterial, insuficiência cardíaca, insuficiência coronariana e suspensão de betabloqueadores em pacientes que já vinham fazendo uso desses fármacos são as mais freqüentes. Quanto aos fatores relacionados ao período intra-operatório, a proteção miocárdica destinada à redução da demanda miocárdica durante o ato cirúrgico, além do tipo de cardioplegia (quente ou fria), são causas questionáveis quanto ao desencadeamento de fibrilação atrial. O mesmo pode ser relatado sobre a circulação extracorpórea, já que, comparativamente aos procedimentos que não utilizam essa técnica, não ocorre maior risco de surgimento de fibrilação atrial após a cirurgia cardíaca(11, 12). Estudos prospectivos publicados recentemente demonstraram, entretanto, que a utilização de circulação extracorpórea associada a cardioplegia é fator determinante para o surgimento de fibrilação atrial em comparação aos pacientes que se submeteram a revascularização miocárdica com o coração batendo(13). As diferenças entre esses estudos podem estar relacionadas com as características das populações envolvidas e não com a técnica cirúrgica propriamente.
No pós-operatório, pericardite causada por pericardiotomia, aumento do tônus simpático, diferentes graus de hipoxia, distúrbios eletrolíticos, além de outros fatores podem desencadear fibrilação atrial(1). A redução da variabilidade do intervalo RR antes da cirurgia, particularmente revascularização miocárdica, identifica pacientes com maior risco para fibrilação atrial no pós-operatório(14). Os níveis plasmáticos de catecolaminas estão elevados no pós-operatório de cirurgia cardíaca(15). Esses achados confirmam a importância do tônus autonômico, tanto simpático como vagal, sobre os átrios ou sobre os mecanismos de controle da freqüência cardíaca após a cirurgia.
Mecanismos eletrofisiológicos
A dispersão da repolarização causada pela heterogeneidade de períodos refratários atriais parece ser a principal responsável pela reentrada do impulso elétrico causador da fibrilação atrial. Quando a frente de onda encontra tecido atrial despolarizado, juntamente com tecido atrial excitável, ocorre sua fragmentação com reativação das regiões previamente não ativadas e manutenção continuada da despolarização elétrica dos átrios. As causas das variações dos períodos refratários são diversas, incluindo dilatação atrial, fibrose tecidual, distensão atrial causada pela retenção hídrica comum no pós-operatório, inflamação pericárdica (pericardiotomia), aumento do tônus simpático e remodelamento elétrico atrial por modificações na expressão genética dos canais de cálcio(16). Não se sabe, ainda, por que pacientes submetidos ao mesmo tipo de cirurgia desenvolvem fibrilação atrial enquanto outros não. Provavelmente, o substrato arritmogênico já exista e seria estimulado por fatores próprios relacionados com a cirurgia. Por outro lado, não se pode descartar influências genéticas ou a modificação da expressão gênica de canais de membrana como um dos fatores determinantes(17).
PACIENTES DE RISCO PARA FIBRILAÇÃO ATRIAL APÓS CIRURGIA CARDÍACA
A identificação do paciente de alto risco para o surgimento de fibrilação atrial no pós-operatório de cirurgia cardíaca permite o tratamento preventivo adequado e pode reduzir a incidência desse distúrbio de ritmo, diminuindo, assim, a morbidade e a mortalidade pós-operatórias. Há também, fundamentalmente, grande impacto econômico com a redução do tempo de permanência do paciente no hospital.
Estudos utilizando o eletrocardiograma de alta resolução da onda P têm demonstrado que a duração dessa onda está prolongada nos pacientes mais propensos a fibrilação atrial (valor preditivo negativo variando entre 82% e 100%; valor preditivo positivo variando entre 37% e 65%)(18-20). Zaman e colaboradores(21), recentemente, demonstraram que duração da onda P acima de 155 ms no eletrocardiograma de alta resolução, idade acima de 75 anos e sexo masculino identificam a maioria dos pacientes com risco para fibrilação atrial após a cirurgia de revascularização miocárdica(21). A longa duração da onda P apresenta, segundo aqueles autores, valor preditivo positivo de 49% e valor preditivo negativo de 84% para identificação correta dos pacientes de alto risco(21).
O eletrocardiograma de 12 derivações pode ser empregado com o mesmo objetivo, com a vantagem de estar disponível em qualquer centro que realize cirurgia cardíaca. Pacientes com predisposição a fibrilação atrial podem apresentar retardos da condução intra-atrial, além de terem diferentes períodos refratários atriais. No eletrocardiograma simples, a presença dessas alterações pode ser sugerida pela observação da presença ou não da dispersão da duração da onda P (diferença entre a maior e a menor duração de P nas 12 derivações eletrocardiográficas). Essa mesma análise já foi empregada para avaliar o risco de fibrilação atrial idiopática em corações normais e demonstrou elevado valor preditivo positivo nessa população(22). No pós-operatório de revascularização miocárdica, realizamos a análise da dispersão da onda P em 59 pacientes (média de idade, 64 + 10 anos), que foram divididos em dois grupos: grupo A, 24 pacientes que desenvolveram fibrilação atrial; grupo B, 35 pacientes sem arritmias. Ambos os grupos eram comparáveis quanto às características clínicas (idade, sexo, fatores de risco, estado da função ventricular, tamanho de átrio esquerdo e número de vasos revascularizados). A média de duração da onda P foi significativamente maior nos pacientes do grupo A em relação aos do grupo B (141 ms + 16 ms "versus" 128 ms + 12 ms; p = 0,05). Do mesmo modo, a dispersão da duração da onda P foi maior no grupo A (53,2 ms + 11 ms "versus" 32,2 ms + 9 ms). Considerando-se um valor de corte de 50 ms para a dispersão da onda P, esse achado apresentou valor preditivo positivo de 94,5%, valor preditivo negativo de 85%, sensibilidade de 74% e especificidade de 97% para a identificação de pacientes de alto risco(23).
Tratamento
O tratamento da fibrilação atrial pode ser realizado por meio da cardioversão química ou elétrica, quando se deseja a reversão ao ritmo sinusal, ou apenas a redução da freqüência cardíaca, para se estabilizar o quadro hemodinâmico. Não existe qualquer estudo prospectivo confirmando os benefícios de uma ou outra conduta, nem mesmo qualquer informação definitiva a respeito dos riscos de tromboembolismo sistêmico ou de sua prevenção com anticoagulantes nessa fase.
Há relatos baseados em análises retrospectivas e num estudo piloto envolvendo pequeno número de pacientes de que o adiamento da cardioversão ao ritmo sinusal, realizando-se apenas o controle da freqüência ventricular e a anticoagulação, parece ser uma conduta prudente e razoável. Com essa atitude, o tempo de permanência no hospital é reduzido, o que traria benefícios econômicos. Por outro lado, os pacientes não estariam expostos aos efeitos colaterais dos medicamentos antiarrítmicos. Segundo a análise retrospectiva realizada por Solomon e colaboradores(24), a fibrilação atrial ocorreu em 16,2% de 487 pacientes que sobreviveram à cirurgia(24). Desses, 67 receberam alta em ritmo sinusal e apenas 12 em fibrilação atrial. O tempo de permanência no hospital nesse último grupo foi de 7,3 + 2,0 dias contra 10,9 + 9,3 dias para os pacientes que saíram em ritmo sinusal (p = 0,003). Observou-se, durante a evolução (222 + 38 dias), que a reversão espontânea da fibrilação atrial ocorreu em 10/12 pacientes (83%), em 9 dos quais nas primeiras 4 semanas após a alta(24). A taxa de reversão espontânea, nesses casos, é similar à que ocorre nos pacientes que desenvolvem essa arritmia em outras condições clínicas. Segundo aqueles autores, não houve qualquer complicação grave pelo fato de os pacientes terem saído do hospital em fibrilação atrial, em comparação com o grupo de pacientes que recebeu alta em ritmo sinusal(24).
Lee e colaboradores(25), num estudo piloto prospectivo envolvendo 50 pacientes com fibrilação atrial após diferentes tipos de cirurgia cardíaca, dividiram a população em dois grupos. No primeiro, trataram de reverter a arritmia ao ritmo sinusal com cardioversão química ou elétrica, além de anticoagulação plena (27 pacientes)(25). O segundo grupo recebeu anticoagulação e medicação para controlar a resposta ventricular (23 pacientes). O objetivo primário do estudo foi avaliar o tempo que os pacientes demoravam para restabelecer o ritmo sinusal com os esquemas empregados(25). Os autores observaram que o tempo para o restabelecimento do ritmo sinusal foi similar em ambos os grupos (11,2 + 32 horas para o grupo conversão "versus" 11,8 + 3,9 horas para o grupo que realizou controle da freqüência ventricular; p = 0,80). O tempo de permanência hospitalar foi menor para o grupo que recebeu antiarrítmicos (9,0 + 0,7 dias "versus" 13,2 + 1,0 dias). O índice de recorrência de fibrilação atrial após a alta hospitalar foi similar (37% "versus" 57%; p = 0,24). Praticamente todos os pacientes estavam em ritmo sinusal após 8 semanas da alta. O risco de complicações foi maior no grupo que recebeu antiarrítmicos em comparação com o grupo que apenas controlou a freqüência cardíaca (43% "versus" 19%). Essas informações iniciais permitiram aos autores concluir que parece não haver diferenças na evolução dos pacientes em relação às estratégias adotadas (reversão ao ritmo sinusal "versus" controle da freqüência cardíaca). A maioria dos pacientes deverá estar em ritmo sinusal após dois meses(25). É provável que os fármacos atualmente disponíveis não apresentem eficácia plena no tratamento dessa arritmia em decorrência das causas multifatoriais da fibrilação atrial. Além disso, esses achados confirmam o caráter transitório da fibrilação atrial no pós-operatório de cirurgia cardíaca, indicando que, realmente, as alterações funcionais sobre um substrato já presente são os gatilhos para seu desencadeamento. Após cessarem aquelas influências, a arritmia deve desaparecer. Essa teoria explicaria as observações do estudo de Lee e colaboradores(25).
Prevenção
O betabloqueador deve ser administrado novamente aos pacientes que vinham fazendo uso desses agentes antes da cirurgia. Já se demonstrou que a utilização desses medicamentos reduz o risco de aparecimento da arritmia e reduz o risco de recorrências(1). Por causa da alta prevalência da fibrilação atrial no pós-operatório de cirurgia cardíaca, há informações recentes de estudos randomizados e controlados com placebo utilizando amiodarona já no pré-operatório, com o objetivo de se prevenir seu surgimento após a cirurgia. Daoud e colaboradores(26) administraram amiodarona na dose de 600 mg por dia, durante sete dias antes da cirurgia, seguidos de 200 mg por dia até a alta hospitalar (dose média de 4,8 g + 0,96 g por um período médio de 13 + 7 dias) a 64 pacientes, enquanto o placebo foi administrado a outros 60 pacientes no mesmo período(26). A fibrilação atrial ocorreu em 16/64 pacientes do grupo da amiodarona (25%) e em 32/60 pacientes do grupo que recebeu placebo (53%) (p = 0,003). Além disso, os pacientes que receberam amiodarona permaneceram menor número de dias hospitalizados em comparação ao grupo que recebeu placebo (6,5 + 2,6 "versus" 7,9 + 4,3 dias; p = 0,04), o que implicou menor custo de hospitalização (US$ 18.375,00 + US$ 13.863,00 "versus" US$ 26.491,00 + US$ 23.837,00; p = 0,03)(26).
Outro estudo utilizou amiodarona por via intravenosa no pós-operatório imediato com o mesmo objetivo. De maneira diferente do estudo anterior, evitou-se o uso prolongado do agente em altas doses por via oral. Como a maioria dos pacientes envolvidos no estudo foi submetida a cirurgia em curto espaço de tempo após a internação, alguns até em regime de urgência, não haveria tempo adequado para se realizar a impregnação oral pré-operatória do medicamento; por essa razão, a formulação venosa foi empregada após a cirurgia. Amiodarona na dose de 1,0 g por dia, durante dois dias, foi administrada no pós-operatório imediato a 142 pacientes, enquanto placebo foi administrado a outros 158 pacientes. Fibrilação atrial ocorreu em 47% dos pacientes que fizeram uso de amiodarona e em 35% dos pacientes do grupo placebo (redução de 26%) (p = 0,01). De maneira diferente ao observado no estudo de Daoud e colaboradores(26), o tempo de permanência no hospital foi similar entre os dois grupos (7,6 + 5,9 "versus" 8,2 + 6,2 dias; p = 0,34)(27). Esses dois grandes estudos demonstraram que a amiodarona é eficaz e segura na redução de fibrilação atrial no pós-operatório de cirurgia cardíaca. Em outro estudo, tratando-se especificamente de pacientes de idade mais avançada (idade acima de 60 anos, média de 73 anos) e que já estavam em uso de betabloqueadores, a amiodarona administrada por via oral no pré-operatório reduziu a incidência de fibrilação atrial, sintomática ou não, em 15,5% em comparação ao grupo que recebeu placebo. Além disso, a incidência de taquicardia ventricular (1,7% "versus" 7,0%, p = 0,04) e de acidente vascular cerebral (1,7% "versus" 7,0%; p = 0,04) no pós-operatório foi significativamente menor no grupo ativamente tratado. O risco de bradicardia ou hipotensão em decorrência da associação de amiodarona e betabloqueador foi similar ao grupo que recebeu placebo e betabloqueador(28).
Estudos menores têm demonstrado a eficácia de outros agentes antiarrítmicos na prevenção de fibrilação atrial no pós-operatório de cirurgia cardíaca. Gomes e colaboradores(29) administraram sotalol na dose média de 190 mg + 43 mg por dia a 40 pacientes, 24 a 48 horas antes da cirurgia de revascularização miocárdica, mantendo a medicação por 4 dias adicionais. O placebo foi administrado a outros 45 pacientes. Nenhum paciente tinha insuficiência cardíaca aparente (fração de ejeção > 28%)(29). A incidência de fibrilação atrial foi de 12,5% no grupo que recebeu sotalol e de 38% no grupo placebo (redução de 67%) (p = 0,008). A necessidade de retirada do sotalol ocorreu em 2 pacientes por causa de hipotensão ou bradicardia. O tempo de permanência hospitalar foi similar entre os dois grupos (7 + 2 dias "versus" 8 + 4 dias para sotalol e placebo, respectivamente)(29).
A prevenção de fibrilação atrial com a utilização de marcapasso para estimulação atrial contínua no pós-operatório imediato vem sendo avaliada nos últimos anos, como alternativa ao uso de medicamentos. Os resultados dos estudos, entretanto, são controversos. Daoud e colaboradores(30) utilizaram estimulação biatrial com programação AAT em 41 pacientes comparados a outros 39 pacientes que receberam marcapasso atrial direito na programação AAI e a 38 pacientes com marcapasso atrial direito com programação AAT. Esses autores observaram que a incidência de fibrilação atrial no pós-operatório foi de 10% no grupo que recebeu marcapasso biatrial, de 28% no grupo com marcapasso AAI e de 32% no grupo que recebeu marcapasso atrial direito em modo AAT. As diferenças observadas entre o primeiro grupo e os outros dois foram estatisticamente significativas(30). Greenberg e colaboradores(31) demonstraram redução da incidência de fibrilação atrial pós-operatória de maneira semelhante a Daoud(30), com a utilização de marcapasso atrial. O gerador foi utilizado em 106 pacientes (estimulação epicárdica de átrio direito [40 pacientes], átrio esquerdo [35 pacientes], biatrial [31 pacientes]), em comparação a 48 pacientes sem marcapasso. Os grupos eram comparáveis quanto às características clínicas (sexo, idade, fatores de risco, fração de ejeção do ventrículo esquerdo, tipo de cirurgia, uso de medicamentos, incluindo betabloqueadores, tempo de circulação extracorpórea e eletrólitos plasmáticos). A incidência de fibrilação atrial nos pacientes com marcapasso foi de 17%, e de 37,5% nos pacientes sem marcapasso (p < 0,005). O tempo de internação dos pacientes que receberam marcapasso foi 22% menor. Não houve diferença quanto à incidência de fibrilação atrial entre os grupos que receberam o marcapasso atrial(31). Em outro estudo publicado na mesma época, Blommaert e colaboradores(32) utilizaram estimulação atrial contínua em programação AAI, empregando um algoritmo de estimulação dinâmica. Nesse caso, os átrios eram permanentemente estimulados a uma freqüência pouco acima da freqüência espontânea do paciente, até um limite de 125 batimentos por minuto, com redução gradual da freqüência de estimulação até o limite mínimo de 80 batimentos por minuto. Esses autores observaram que a incidência de fibrilação atrial pós-operatória foi de 10% nos pacientes estimulados e de 27% nos pacientes sem estimulação atrial (p = 0,036). Os resultados apresentaram-se melhores nos pacientes com melhor função ventricular e que receberam marcapasso, em comparação àqueles sem marcapasso(32).
Chung e colaboradores(33) empregaram marcapasso epicárdico com estimulação atrial contínua na programação AAI a 51 pacientes, em comparação a não-estimulação em 51 pacientes submetidos a revascularização miocárdica. A incidência de fibrilação atrial foi de 25,5% nos pacientes que receberam a estimulação e de 28,6% nos pacientes sem estimulação (p = 0,90). Esses autores concluíram que a estimulação atrial não reduz a incidência de fibrilação atrial após a cirurgia cardíaca, podendo até mesmo apresentar efeito pró-arrítmico, com aumento do número de extra-sístoles atriais(33).
De maneira geral, há algumas evidências apontando para o uso de marcapasso temporário com estimulação atrial contínua para se reduzir o risco de fibrilação atrial após a cirurgia cardíaca. Deve-se, contudo, avaliar os riscos e benefícios dessa conduta e, de maneira importante, também os custos. Para tornar a abordagem mais racional e economicamente viável, o implante de fios epicárdicos poderia ficar restrito somente aos pacientes com maior risco para fibrilação atrial. Nesse caso, a avaliação clínica pré-operatória, incluindo exames complementares (eletrocardiograma de 12 derivações, eletrocardiograma de alta resolução da onda P, ecocardiograma, etc.), seria fundamental.
Reversão química ou elétrica
Com relação à reversão da fibrilação atrial, os resultados da cardioversão química no período pós-operatório parecem não diferir dos pacientes que apresentam a arritmia em outras situações. Não há qualquer estudo controlado que compare a eficácia dos medicamentos antiarrítmicos para reversão da arritmia especificamente após a cirurgia. Gentili e colaboradores(34) administraram propafenona por via intravenosa (2 mg/kg em 10 minutos) a 50 pacientes submetidos a revascularização miocárdica ou a troca valvar aórtica, cerca de 15 minutos após o início da arritmia. Reversão ao ritmo sinusal foi observada em 35 pacientes (70%) após um tempo médio de 22 + 6 minutos do início da infusão. A eficácia foi maior nos pacientes revascularizados (88%) que naqueles que trocaram a válvula aórtica (39%) (p < 0,001). Nos pacientes nos quais a arritmia não reverteu, a freqüência cardíaca foi significativamente menor no grupo que recebeu propafenona (108 + 9 "versus" 142 + 14 batimentos por minuto; p < 0,01)(34). McAlister e colaboradores(35) compararam a segurança e a eficácia da quinidina por via oral em relação à amiodarona por via venosa para reversão de taquiarritmias após a cirurgia cardíaca. Observaram que a quinidina apresentava maior incidência de reversão ao ritmo sinusal que a amiodarona (64% "versus" 41%; p = 0,04); entretanto, associou-se a maior risco de efeitos adversos (46% "versus" 12%)(35).
Anticoagulação
Não deve haver diferenças na conduta de se anticoagular pacientes que apresentam fibrilação atrial durante o pós-operatório de cirurgia cardíaca, em comparação com os pacientes em outras condições clínicas. A formação de trombos após a instalação da arritmia ocorre em até 14% dos casos num período de evolução inferior a 48 horas(36). É prudente a heparinização em pacientes de alto risco (pacientes com história prévia de embolia, insuficiência cardíaca, valvopatia mitral, diabete melito, hipertensos, idosos com mais de 75 anos de idade) até que o efeito pleno do anticoagulante seja estabelecido (INR entre 2 e 3). Não há estudos prospectivos que avaliem os riscos e benefícios da anticoagulação de pacientes com fibrilação atrial no pós-operatório de cirurgia cardíaca.
OUTRAS ARRITMIAS SUPRAVENTRICULARES
"Flutter" atrial
Ocorre em cerca de 30% dos pacientes após cirurgia cardíaca, tanto de cardiopatias congênitas (as mais comuns são após a cirurgia de Mustard ou Senning, Blalock-Hanlon, correção de comunicação interatrial e tetralogia de Fallot), como valvares (valvopatias mitral e aórtica) ou revascularização miocárdica. Suas causas podem ser as mesmas relacionadas com a origem da fibrilação atrial.
O diagnóstico eletrocardiográfico deve ser sempre
suspeitado quando o paciente apresenta taquicardia com ritmo regular, ondas P
não-visíveis e freqüência ventricular de cerca de 150 batimentos por minuto.
As derivações epicárdicas bipolares auxiliam o diagnóstico quando, na
dependência da condução atrioventricular, são registradas duas ondas atriais
(ondas F) com freqüência de 300 batimentos por minuto ou mais, para cada
complexo QRS (condução 2:1, por exemplo)(2) (Fig. 4). Ao
eletrocardiograma distinguem-se ondas F negativas ou positivas nas derivações
D2, D3 e aVF, com freqüências que variam entre 300 e 433 batimentos por minuto
("flutter" tipo comum) ou acima desses limites ("flutter" tipo incomum).
|
|
|
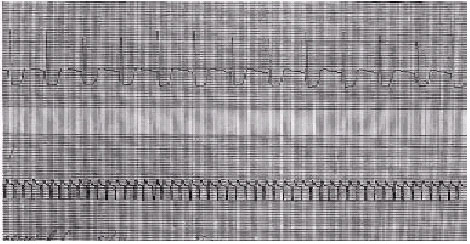
Figura 4. Derivação eletrocardiográfica obtida de monitor cardíaco (canal superior) simultaneamente ao eletrograma epicárdico bipolar do átrio direito (canal inferior) durante episódio de “flutter” atrial com condução atrioventricular variável, em paciente evoluindo no pósoperatório de troca valvar mitral. Observa-se freqüência atrial rápida (333 batimentos por minuto) e atividade elétrica atrial organizada, com eletrogramas uniformes separados por linha isoelétrica, característica dessa arritmia. |
O tratamento dependerá das condições clínicas e hemodinâmicas do paciente. Se estiver estável, poderá ser tentada inicialmente a reversão por meio da estimulação atrial com os fios epicárdicos(3, 37, 38). Aconselha-se, nesses casos, a estimulação com freqüência de 10 batimentos a mais que a freqüência atrial, aumentando-se gradativamente. Cada etapa deve ter duração de pelo menos 20 a 30 segundos, sendo limitada pelo surgimento de sintomas em decorrência de hipotensão arterial causada pela estimulação atrial muito rápida. Poderá haver degeneração do "flutter" para fibrilação atrial e, algum tempo depois, para ritmo sinusal, já que a fibrilação atrial é um ritmo instável nessa situação(37, 38). De outro modo, logo após a interrupção da estimulação, o ritmo sinusal poderá ser observado. Essa técnica pode ser sensibilizada pela administração de um antiarrítmico, como a procainamida, que reduz a freqüência atrial e permite que a frente de onda desencadeada pelo estimulador artificial penetre o circuito arritmogênico e interrompa o "flutter"(39).
Não há qualquer diretriz sobre usar-se ou não antiarrítmico para prevenir futuras recorrências de "flutter" atrial após a cirurgia, embora seja conhecido que tanto o flutter como a fibrilação atrial são alterações do ritmo muito freqüentes e transitórias nesse período. A conduta preventiva com amiodarona, tal como foi idealizado para a fibrilação atrial, pode ser empregada. Não devem ser utilizados fármacos que deprimam a função ventricular, para se evitar descompensações hemodinâmicas, facilitadas pela freqüência cardíaca rápida. O tempo durante o qual o agente deverá ser empregado ainda não está determinado, mas de 8 a 12 semanas após a alta hospitalar parece ser um período razoável para se prevenir as recorrências.
Taquicardia atrial
A taquicardia atrial é menos comum que o "flutter" e a fibrilação atrial. Não raramente os pacientes já tinham a taquicardia antes da cirurgia. A intoxicação digitálica é um fator predisponente para o surgimento dessa arritmia. Além dessa causa, a distensão atrial causada pela cardiopatia subjacente (como a estenose mitral) e as áreas de lesão nos átrios, principalmente no local de canulação para circulação extracorpórea ou atriotomias para correções de cardiopatias congênitas, devem ser consideradas.
O diagnóstico utilizando fios epicárdicos estabelece
facilmente a relação entre as ondas P e os complexos QRS. A freqüência atrial
costuma ser inferior a 300 batimentos por minuto e a condução atrioventricular
é variável, na dependência da freqüência dos átrios, estando na relação 1:1,
2:1, etc. (Fig. 5).
|
|
|
Figura 5. Derivação eletrocardiográfica obtida de monitor cardíaco (canal superior) simultaneamente ao eletrograma epicárdico bipolar do átrio direito (canal inferior) durante episódio de taquicardia atrial paroxística com condução atrioventricular 2:1 em paciente evoluindo no pós-operatório de revascularização miocárdica. A atividade elétrica atrial é organizada, com eletrogramas uniformes e separados por linha isoelétrica. A condução atrioventricular é variável por causa da freqüência atrial rápida (166 batimentos por minuto). |
Quanto ao tratamento, devem ser evitados fármacos do grupo I pela ineficácia e pelo maior risco de efeitos colaterais, dando-se preferência para a amiodarona. A cardioversão elétrica nem sempre dá resultados, já que a arritmia tende a recorrer. Por essa razão, quando não se consegue a reversão logo após a cirurgia, administram-se medicamentos para redução da resposta ventricular. Os betabloqueadores e os antagonistas de cálcio são os mais indicados. Nos casos de intoxicação digitálica, deve-se suspender o medicamento e administrar potássio, caso os níveis plasmáticos estejam abaixo de 3,5 mEq/l. Os fios de marcapasso temporário podem ser utilizados para estimulação atrial artificial para reversão da taquicardia(37, 38). Procede-se à estimulação de maneira similar à preconizada para o "flutter" atrial. Quando se consegue captura atrial eficaz com freqüências rápidas, é possível que a resposta ventricular fique abaixo daquela determinada pela taquicardia, por causa do bloqueio atrioventricular 2:1(37, 38). Em muitos casos, essa situação é mais bem tolerada pelo paciente. Como a taquicardia atrial costuma ser um ritmo transitório, podem ser realizadas tentativas diárias de interrupção da estimulação para se certificar do restabelecimento definitivo do ritmo sinusal. Enquanto se procede à estimulação, aguarda-se também o efeito do medicamento antiarrítmico para estabilização dos átrios.
Taquicardia juncional não-paroxística
Essa arritmia costuma ser transitória e de curta duração, sendo mais freqüente no pós-operatório de cardiopatias congênitas, embora podendo ser também encontrada após cirurgia valvar ou revascularização coronária em adultos. Parece ser secundária especificamente à redução dos níveis plasmáticos de magnésio, pois a administração prévia de sulfato de magnésio ou sua reposição pós-operatória diminui sua incidência(40). Há relatos, também, de que focos automáticos originados próximo ao feixe de His podem ser formados por infiltrados hemorrágicos causados pela sutura durante o fechamento de comunicação interventricular(41). Intoxicação digitálica, hipopotassemia, hipoxia e acidose metabólica são outros fatores que podem desencadear taquicardia juncional não-paroxística.
A principal complicação relacionada a essa arritmia é a insuficiência cardíaca secundária à freqüência cardíaca rápida, a dissociação atrioventricular e a insuficiência valvar. Colapso hemodinâmico que culmina com morte pode ocorrer em taquicardias rápidas e duradouras em pacientes com disfunção ventricular(38).
O diagnóstico eletrocardiográfico é muito facilitado pela
derivação epicárdica registrada simultaneamente a uma derivação
eletrocardiográfica comum. Nesse caso, há dissociação atrioventricular
(freqüência ventricular mais rápida que a atrial), a morfologia dos complexos
QRS é similar àquela durante ritmo sinusal normal, e pode haver captura atrial
retrógrada 1:1 (Fig. 6).
|
|
|
Figura 6. Derivação eletrocardiográfica obtida de monitor cardíaco (canal superior) simultaneamente ao eletrograma epicárdico bipolar do átrio direito (canal inferior) durante episódio de taquicardia juncional não-paroxística em paciente evoluindo no pós-operatório de comunicação interventricular. Observa-se que os cinco primeiros batimentos da esquerda para a direita correspondem à taquicardia juncional com captura atrial retrógrada (o eletrograma menor corresponde à atividade ventricular e o maior, à atividade atrial). Após extra-sístole ventricular, o ritmo sinusal assume o comando, com a atividade atrial precedendo a ventricular (inversão na ordem dos eletrogramas). O complexo QRS nas duas condições tem a mesma morfologia. Notase que o ritmo atrial (de origem sinusal) não é influenciado pelas duas extra-sístoles originadas nos ventrículos. |
Tratamento
Sempre que possível, devem ser estabelecidas as condições metabólicas ideais por meio de correção de eventuais alterações da gasometria arterial e reposição eletrolítica. A amiodarona parecer ser o fármaco mais eficaz, tanto para a reversão como para a redução da freqüência ventricular(42). A propafenona e a procainamida são outras opções que podem ser testadas. Há relatos do emprego da redução da temperatura corpórea como método eficaz, tanto para reduzir a freqüência cardíaca como para a reversão ao ritmo sinusal(43). Enquanto a temperatura é rebaixada, administram-se medicamentos para estabilizar e manter o ritmo sinusal. A estimulação atrial artificial por meio de eletrodos de marcapasso temporário suturados ao átrio direito pode dar bons resultados para o controle da freqüência e também para a normalização do ritmo cardíaco(37, 38). Estimula-se o átrio com freqüências progressivamente crescentes (começando com 10 a 20 batimentos por minuto acima da freqüência da taquicardia) até se atingir a captura ventricular completa. A freqüência do estimulador pode ser reduzida abruptamente ou gradualmente para se verificar o restabelecimento do ritmo sinusal. Geralmente esse ritmo é alcançado quando a estimulação atrial corresponde a 130% da freqüência da taquicardia juncional(37, 38). O tempo médio de estimulação corresponde a cerca de 30 segundos. A freqüência máxima de estimulação é determinada pela tolerância hemodinâmica do paciente. Quando não se consegue a reversão, pode-se obter bloqueio atrioventricular de grau variável durante a estimulação, correspondendo, nessa situação, a uma freqüência cardíaca menor que a da taquicardia, com a vantagem de a contração atrial estar sempre presente, melhorando o quadro clínico do paciente. A estimulação atrial simplesmente, com freqüência mais rápida que a da taquicardia, pode suprimir a atividade do foco automático e interromper a taquicardia(37, 38).
Taquicardia e fibrilação ventricular
São arritmias pouco freqüentes no pós-operatório de cirurgia cardíaca. Por essa razão, são escassos os estudos nessa área, o que não permite estabelecer com exatidão as causas mais comuns e o tipo de tratamento mais adequado dessa condição. A taquicardia ventricular costuma aparecer entre as primeiras 48 horas e até 7 dias após a cirurgia cardíaca(44) e, apesar de pouco freqüente, é potencialmente letal. Há relatos de mortalidade em até 44% dos pacientes acometidos(45).
As causas relatadas por estudos retrospectivos apontam hipoxia, distúrbios eletrolíticos (hipomagnesemia, hipocalemia) e do equilíbrio ácido-básico (acidose metabólica), infarto agudo do miocárdio, oclusão de enxertos coronarianos, isquemia, medicamentos (digital, fármacos simpaticomiméticos utilizados para suporte hemodinâmico, antiarrítmicos utilizados para o tratamento de outras arritmias, como a fibrilação atrial) e condições clínicas que evoluem com baixo débito cardíaco(46). A descarga adrenérgica, muito comum no pós-operatório, pode desencadear taquicardia ou fibrilação ventricular em indivíduos predispostos. Esses pacientes mais propensos a taquiarritmias malignas têm história prévia de disfunção ventricular, taquicardia ventricular ou infarto do miocárdio. As cardiopatias congênitas que mais apresentam taquicardia ventricular após o tratamento cirúrgico são a tetralogia de Fallot(47) e a anomalia de Ebstein(48).
O diagnóstico da taquicardia ventricular é feito por meio do eletrocardiograma de 12 derivações, mas o diagnóstico diferencial com taquicardia supraventricular com condução aberrante deve ser sempre considerado. Os fios epicárdicos atriais são úteis para confirmar a presença de dissociação atrioventricular e a origem ventricular da taquicardia.
Tratamento
O tratamento da taquicardia ventricular no pós-operatório não difere das outras condições em que a arritmia aparece. No caso de colapso hemodinâmico, a cardioversão elétrica está indicada. Em pacientes estáveis, pode ser tentada a estimulação ventricular com os fios epicárdicos(38). Procede-se à estimulação com freqüências 10 batimentos acima da freqüência da taquicardia, até se observar captura ventricular completa, repetindo-se a freqüências progressivamente maiores até que se obtenha a interrupção da taquicardia. A freqüência máxima de estimulação (geralmente, 125% da freqüência ventricular da taquicardia)(38) e o tempo de estimulação dependerão da tolerância pelo paciente. Freqüências muito rápidas acompanham-se de hipotensão arterial significativa, podendo precipitar fibrilação ventricular. Por essa razão, é importante ter o desfibrilador elétrico disponível. O tratamento medicamentoso pode ser feito com lidocaína, procainamida ou amiodarona por via venosa.
Após o restabelecimento do ritmo sinusal, deve-se proceder à identificação da causa que gerou a taquicardia, por causa do risco elevado de recorrência. Não há qualquer estudo sistemático que defina a conduta terapêutica nesses casos. A administração de amiodarona empírica é uma conduta razoável na prevenção de recorrências, baseada nas informações dos estudos clínicos EMIAT e CAMIAT(49, 50). De acordo com esses estudos, a amiodarona reduz o risco de morte súbita, mas não interfere com o risco de morte por outras causas. A necessidade de estudo eletrofisiológico para se guiar a terapêutica ou até mesmo para se determinar a necessidade de implante de desfibrilador automático deve ser avaliada caso a caso.
REFERÊNCIAS
1. Ommen SR, Odell JA, Stanton MSS. Atrial arrhythmias after cardiothoracic surgery. N Engl J Med 1997;336:1429-34.
2. Waldo AL, MacLean WAH. Diagnosis and treatment of arrhythmias following open heart surgery. Emphasis on the use of atrial and ventricular epicardial wire electrodes. Mt. Kisco, New York: Futura Publishing Co., Inc.; 1980. p.1-20.
3. Waldo AL, MacLean WAH. Diagnosis and treatment of arrhythmias following open heart surgery. Emphasis on the use of atrial and ventricular epicardial wire electrodes. Mt. Kisco, New York: Futura Publishing Co., Inc.; 1980. p.20-8.
4. Moreira DAR. Arritmias Cardíacas: Clínica, Diagnóstico e Terapêutica. São Paulo: Artes Médicas; 1995. p.28-38.
5. Ortiz J, Sokoloski MC, Ayers GM, Cmolik BL, Niwano S, Geha AS, et al. Atrial defibrillation using temporary epicardial defibrillation stainless steel wire electrodes: studies in the canine sterile pericarditis model. J Am Coll Cardiol 1995;26:1356-64.
6. Liebold A, Rodig G, Birnbaum DE. Performance of temporary epicardial stainless steel wire electrodes used to treat atrial fibrillation: a study in patients following open heart surgery. Pg Clin Electrophysiol 1999;22:315-9.
7. Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery surgery. Circulation 1996;94:390-7.
8. Matthew JP, Parks R, Savino JS, et al. Atrial fibrillation following coronary artery bypass graft surgery. JAMA 1996;276:300-6.
9. Creswell L, Schuesller RB, Rosembloom M, Cox JL. Hazards of postoperative atrial arrhythmias. Ann Thorac Surg 1993;56:539-49.
10. Reed GL III, Singer DE, Picard EH, DeSanctis RW. Stroke following caronary-artery bypass surgery: a case control estimate of the risk from carotid bruits. N Engl J Med 1988;319:1246-50.
11. Tamis-Holland JE, Homel P, Durani M, et al. Atrial fibrillation after minimally invasive direct coronary artery bypass surgery. J Am Coll Cardiol 2000;36:1884-8.
12. Siebert J, Anisimowicz L, Lango R, et al. Atrial fibrillation after coronary artery bypass grafting: does the type of procedure influence the early postoperative incidence? Eur J Cardiothorac Surg 2001;19:455-9.
13. Ascione R, Caputo M, Calori G, Lloyd CT, Underwood MJ, Angelini GD. Predictors of atrial fibrillation after conventional and beating heart coronary surgery: a prospective, randomized study. Circulation 2000;102: 1530-5.
14. Hogue CW Jr, Domitrovich PP, Stein PK, et al. RR interval dynamics before atrial fibrillation in patients after coronary artery bypass surgery. Circulation 1998;63:552-64.
15. Kalman JM, Munawar M, Howes LG, et al. Atrial fibrillation after coronary artery bypass grafting is associated with sympathetic activation. Ann Thorac Surg 1995;60:1709-15.
16. Hogue CW Jr, Hyder ML. Atrial fibrillation after cardiac operation: risks, mechanisms, and treatment. Ann Thorac Surg 2000;69:300-6.
17. Dupont E, Ko Y, Rothery S, et al. The gap junctional protein connexin40 is elevated in patients susceptible to postoperative atrial fibrillation. Circulation 2001;103:842-9.
18. Steinberg JS, Zelenkofske S, Wong S-C, Gelernt M, Sciacca R, Menchavez E. Value of the P wave signal-averaged ECG for predicting atrial fibrillation after cardiac surgery. Circulation 1993;88:2618-22.
19. Klein M, Evans SJL, Blumberg S, Cataldo L, Bodenheimer MM. Use of P wave-triggered, P-wave signal-averaged electrocardiogram to predict atrial fibrillation after coronary artery bypass surgery. Am Heart J 1995;129:895-901.
20. Tuzcu V, Ozkan B, Sullivan N, Karpawich P, Epstein ML. P wave signal-averaged electrocardiogram as a new marker for atrial tachyarrhythmias in postoperative Fontan patients. J Am Coll Cardiol 2000;36:602-7.
21. Zaman AG, Archbold A, Helft G, Paul EA, Curzen NP, Mills PG. Atrial fibrillation after coronary artery bypass surgery. A model for preoperative risk stratification. Circulation 2000;101:1403-8.
22. Dilaveris PE, Gialafos EJ, Sideris SK, et al. Simple electrocardiographic markers for the prediction of paroxysmal idiopathic atrial fibrillation. Am Heart J 1998;135:733-8.
23. Moreira D, Gun C, Sierra C, et al. Critérios eletrocardiográficos para previsão de fibrilação atrial após a cirurgia cardíaca. Arq Bras Cardiol 1999;73(sup IV):81.
24. Solomon AJ, Kourets PC, Hopkins RA, Katz NM, Wallace RB, Hannan RL. Early discharge of patients with new-onset atrial fibrillation after cardiovascular surgery. Am Heart J 1998;135:557.
25. Lee JK, Klein GK, Krahn AD, et al. Rate-control versus conversion strategy in postoperative atrial fibrillation: a prospective, randomized pilot study. Am Heart J 2000;14:871-7.
26. Daoud EG, Strickberger A, Man C, et al. Preoperative amiodarone as prophylaxis against atrial fibrillation after heart surgery. N Engl J Med 1997;337:1785-91.
27. Guarnieri T, Nolan S, Gottlieb SO, Dudek A, Lowry DR. Intravenous amiodarone for the prevention of atrial fibrillation after open heart surgery: The Amiodarone Reduction in Coronary Heart (ARCH) trial. J Am Coll Cardiol 1999;34:343-7.
28. Giri S, White CM, Dunn AB, et al. Oral amiodarone for prevention of atrial fibrillation after open heart surgery: The Atrial Fibrillation Suppression Trial (AFIST): a randomized placebo-controlled trial. Lancet 2001;357:830-6.
29. Gomes JA, Ip J, Santoni-Rugiu F, et al. Oral d,l sotalol reduces the incidence of postoperative atrial fibrillation in coronary artery bypass surgery patients: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 1999;34:334-9.
30. Daoud EG, Dair R, Archambeau M, Morady F, Strickberger SA. Randomized, double-blind trial of simultaneous right and left atrial epicardial pacing for prevention of post-open heart surgery atrial fibrillation. Circulation 2000;102:761-5.
31. Greenberg MD, Katz NM, Iuliano S, Tempesta BJ, Solomon AJ. Atrial pacing for prevention of atrial fibrillation after cardiovascular surgery. J Am Coll Cardiol 2000;35:1416-22.
32. Blommaert D, Gonzalez M, Mucumbitsi J, et al. Effective prevention of atrial fibrillation by continuous atrial overdrive pacing after coronary artery bypass surgery. J Am Coll Cardiol 2000;35:1411-5.
33. Chung MK, Augostini RS, Asher CR, et al. Ineffectiveness and potential proarrhythmia of atrial pacing for atrial fibrillation prevention after coronary artery bypass grafting. Ann Thorac Surg 2000;69:1057-63.
34. Gentili C, Giordano F, Alois A, Massa E, Bianconi L. Efficacy of intravenous propafenone in acute atrial fibrillation complicating open-heart surgery. Am Heart J 1992;123:1225-8.
35. McAlister HF, Luke RA, Whitlock RM, Smith WM. Intravenous amiodarone bolus versus oral quinidine for atrial flutter and fibrillation after cardiac operations. J Thorac Cardiovasc Surg 1990;99:911-8.
36. Stoddard MF, Dawkins PR, Prince CR, Ammash NM. Left atrial appendage thrombus is not uncommon in patients with acute atrial fibrillation and a recent embolic event: a transesophageal echocardiographic study. J Am Coll Cardiol 1995;25:452-9.
37. Waldo AL, MacLean WAK, Karp RB, et al. Continuous rapid atrial pacing to control recurrent or sustained supraventricular tachycardias following open heart surgery. Circulation 1976;245-52.
38. Waldo AL, MacLean WAH. Diagnosis and treatment of arrhythmias following open heart surgery. Emphasis on the use of atrial and ventricular epicardial wire electrodes. Mt. Kisco, New York: Futura Publishing Co., Inc.; 1980. p.116-50.
39. Olshansky B, Okumura K, Hess PG, Henthorn RW, Waldo AL. Use of procainamide with rapid atrial pacing for successful conversion of atrial flutter to sinus rhythm. J Am Coll Cardiol 1988;11:359-64.
40. Dorman BH, Sade RM, Burnette JS, et al. Magnesium supplementation in the prevention of arrhythmias in pediatric patients undergoing surgery for congenital heart defects. Am Heart J 2000;139:522-8.
41. Till JA, Ho SY, Rowland E. Histopathological findings in three children with His bundle tachycardia occurring subsequent to cardiac surgery. Eur Heart J 1992;13:709-12.
42. Raja P, Hawker RE, Chaikitpinyo A, et al. Amiodarone management of junctional ectopic tachycardia after cardiac surgery in children. Br Heart J 1994;72:261-5.
43. Bash SE, Shah JJ, Albers WH, Geiss DM. Hypothermia for the treatment of postsurgical greatly accelerated junctional ectopic tachycardia. J Am Coll Cardiol 1987;10:1095-9.
44. Tam SKC, Miller JM, Edmunds LH Jr. Unexpected, sustained ventricular tachyarrhythmia after cardiac operations. J Thorac Cardiovasc Surg 1991;102:883-9.
45. Kron IL, DiMarco JP, Harman PK, et al. Unanticipated postoperative ventricular tachyarrhythmias. Ann Thorac Surg 1984;38:317-22.
46. Lauer MS, Eagle KA. Arrhythmias following cardiac surgery. In: Podrid PJ, Kowey PR, eds. Cardiac Arrhythmia. Mechanisms, Diagnosis, and Management. Baltimore: Williams & Wilkins; 1995. p.1206-18.
47. Carlson MD, Biblo LA, Waldo AL. Post open heart surgery ventricular arrhythmias. Cardiovasc Clin 1992;22:241-53.
48. Oh JK, Holmes DR Jr, Hayes DL, et al. Cardiac arrhythmias in patients with surgical repair of Ebstein's anomaly. J Am Coll Cardiol 1985;6:1351-7.
49. Cairns JA, Connolly SJ, Roberts R, Gent M, for the CAMIAT Investigators. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Lancet 1997;349:675-82.
50. Julian DG, Camm AJ, Janse MJ, Munoz A, Schwartz PJ,
Simon P, for the European Myocardial Infarct Amiodarone Trial Investigators.
Lancet 1997;349:667-74.