TRATAMENTO CIRÚRGICO DAS DISSECÇÕES DA AORTA ASCENDENTE
Divisão de Cirurgia — Instituto do Coração (InCor) — HC-FMUSP
Endereço para correspondência:
Av. Dr. Enéas Carvalho de Aguiar, 44 — 2º andar — CEP 05403-000 — São Paulo —
SP
HISTÓRICO
A doença dissecção da aorta foi primeiramente reconhecida no século XVI(1), porém somente no século XVIII, com Morgagni (1761),(2) é que foram feitas as primeiras descrições pormenorizadas dos achados anatomopatológicos dessa afecção(2). Shennan,(3) em 1934, descreve com detalhes a doença, ressaltando sua evolução fulminante na maioria dos casos, sugerindo, desde então, a necessidade de algum tipo de intervenção para essa população de pacientes.
A necessidade de intervenção cirúrgica imediata para os casos agudos (doença com até 14 dias de evolução) deve-se a sua fulminante história natural, cuja evolução pode chegar até a 90% de mortalidade ao final da fase aguda. Ela apresenta evolução tão agressiva que alguns autores chegaram a sugerir que o risco de morte é estimado em 1% por hora, nas primeiras 48 horas; 8% por dia, do segundo ao sétimo dias; e 5% por dia, do oitavo ao décimo quarto dias(4-6).
Essa evolução maligna é válida somente para as dissecções da aorta ascendente, em que o mecanismo de morte está relacionado com a rotura da falsa luz, levando o paciente à morte por tamponamento cardíaco (quando roto dentro do pericárdio), por sangramento (hemomediastino ou hemotórax) ou por infarto agudo do miocárdio.
As primeiras propostas de abordagem cirúrgica restringiram-se a intervenções indiretas sobre a doença, ou melhor, sobre suas conseqüências de isquemia à distância. A primeira proposta foi sugerida por Gurin e colaboradores(7), em 1935; por meio de fenestração distal da luz da aorta, criava-se uma reentrada distal na aorta doente, restabelecendo a circulação em paciente com isquemia de membro inferior por compressão da luz verdadeira pela falsa luz da aorta dissecada(7). Vários autores demonstraram, posteriormente, que a fenestração, apesar de poder aliviar sintomas, não alterava a história natural da doença. Foram tentados, ainda, outros métodos indiretos, tais como o envolvimento da região da aorta doente com celofane(8) e a sutura direta do local da rotura em aorta abdominal(9), também sem sucesso.
Foi, porém, a partir da idéia da abordagem direta da lesão, sugerida por DeBakey e colaboradores,(10) que a cirurgia da dissecção de aorta efetivamente começou a existir. Foi descrita, inicialmente, em 1954(10), a ressecção de segmento da aorta descendente dissecada e a interposição de prótese vascular no local acometido. Spencer e Blake,(11) em 1962, realizaram pela primeira vez, com sucesso, o tratamento de paciente com dissecção crônica da aorta ascendente e lançaram as bases da cirurgia atual para o tratamento das afecções da aorta ascendente, a partir da idéia inicial proposta por Bahnson e Spencer, em 1960(12).
Em paralelo à abordagem direta da aorta ascendente, outro fator que influiu decisivamente na evolução positiva dessa população de pacientes foi a associação com o tratamento medicamentoso, que visa à redução ou ao controle da onda de pulso e da contratilidade do ventrículo esquerdo, para a estabilização da dissecção consumada. A alteração da mortalidade com a terapia medicamentosa foi evidente, principalmente para os portadores de dissecção da aorta do tipo III de DeBakey(13).
Conjuntamente à evolução das próteses vasculares, da utilização das colas biológicas para reforço na parede de aorta friável, das técnicas de circulação extracorpórea (visando à manutenção do fluxo de perfusão anterógrada na aorta dissecada durante o período de resfriamento e de aquecimento) e das técnicas de hipotermia profunda com parada circulatória total para a realização da anastomose distal da aorta sem sua oclusão, hoje é possível o tratamento cirúrgico desses pacientes com resultados bastante satisfatórios(14-21).
DIAGNÓSTICO E CONDUTA
Os pacientes com dissecção aguda da aorta ascendente na maioria das vezes apresentam-se com dor torácica aguda de forte intensidade, irradiada ou não para pescoço, ombro, dorso e até para abdome e membros inferiores. Ao exame físico, poderão apresentar sopro semelhante ao de insuficiência aórtica, diferencial de pulsos ou de pressão entre os membros, alterações neurológicas, sinais de isquemia mesentérica, de isquemia renal, paraplegia e até instabilidade hemodinâmica, além dos sinais de liberação simpática, tais como sudorese profusa, palidez, taquicardia, tremores, náuseas e vômitos(22).
A partir da radiografia simples de tórax e da ecocardiografia transesofágica (visando à avaliação da aorta, do orifício de entrada e da falsa luz do vaso; à avaliação da valva aórtica, para identificar a existência de insuficiência aórtica; e à avaliação da existência de derrame pericárdico), o cirurgião dispõe dos dados suficientes para encaminhar o paciente para a sala de operações(23). Nos pacientes que se encontram na fase aguda da doença ou hemodinamicamente instáveis, com persistência de dúvida diagnóstica, a investigação pode ser complementada pela realização da tomografia helicoidal, principalmente pela sensibilidade e pela rapidez de execução do método(24).
Nos casos de dissecção crônica da aorta ascendente, a investigação pré-operatória deve ser mais completa. A cineangiocoronariografia associada à aortografia é recomendada e, se necessário, o exame de ressonância nuclear magnética é bastante ilustrativo. Nos casos de dissecção crônica da aorta ascendente, a indicação cirúrgica só ocorrerá se houver persistência da dor (sinal de progressão da dissecção), insuficiência aórtica significativa ou diâmetro da aorta maior que 5 cm.
Dentre os diagnósticos diferenciais, devem ser excluídos o aneurisma verdadeiro da aorta, o infarto agudo do miocárdio (que não secundário à dissecção aórtica), a embolia pulmonar, a pericardite, a insuficiência aórtica de outra etiologia, as dores musculoesqueléticas e os tumores do mediastino(22).
TRATAMENTO CIRÚRGICO
O tratamento cirúrgico atual visa à substituição da aorta ascendente doente, podendo ser estendida até o arco aórtico. Nos casos de dissecção aguda, a opção da maior parte dos cirurgiões tem sido pela hipotermia profunda e pela parada circulatória total, para a realização da anastomose distal da prótese vascular sem o pinçamento primário da aorta doente, assim como tem sido a preservação da valva aórtica, na maior parte dos casos, por meio da suspensão da mesma.
Paralelamente à realização da esternotomia, deve ser feito o preparo para a instalação da circulação extracorpórea, em geral com canulação arterial da artéria femoral direita. Atualmente, existe, porém, tendência à canulação arterial das artérias axilar, subclávia ou carótida, visando ao fluxo sanguíneo arterial anterógrado desde o início da circulação extracorpórea.
Após o preparo da artéria para a instalação da linha arterial, realiza-se esternotomia mediana longitudinal, pericardiotomia e identificação da aorta dilatada. Após a heparinização sistêmica, para a drenagem venosa, é realizada a canulação individual das veias cavas superior e inferior por meio do átrio direito, sendo a superior cadarçada para possibilitar a retroperfusão cerebral. A drenagem das câmaras esquerdas é feita por cateter colocado no ventrículo esquerdo, introduzido pela veia pulmonar superior direita.
Uma vez em circulação extracorpórea, resfria-se o paciente até 18oC, com fluxo arterial anterógrado, o que garante a perfusão cerebral enquanto ocorre o resfriamento à temperatura segura para a parada circulatória total. O recurso adicional mais utilizado na proteção cerebral é a retroperfusão cerebral, pela veia cava superior, com pressão de perfusão de até 25 mmHg. Alguns cirurgiões têm realizado, após a parada circulatória total, a perfusão cerebral anterógrada, com resultados satisfatórios.
A proteção miocárdica é iniciada imediatamente após a aortotomia, por meio de solução cardioplégica sanguínea fria nos óstios coronários a cada 20 minutos.
A anastomose distal é realizada sem o pinçamento prévio da aorta delaminada. Em função da fragilidade de suas camadas, suas bordas são submetidas a reforço com duas tiras de teflon, uma interna e outra externa, e somente após esse reforço é realizada a sutura direta em tubo vascular adequado ao diâmetro da aorta em reconstrução. Uma vez terminada a anastomose, realizam-se as manobras para retirada de ar, e restabelecem-se a circulação extracorpórea e o reaquecimento do paciente, que deve ser de forma lenta e gradativa (1oC a cada três minutos).
Durante o reaquecimento com o pinçamento da prótese, é preparada a borda proximal da aorta à semelhança da distal e posterior sutura direta no enxerto (Fig. 1).
As anastomoses podem ser reforçadas por meio da aplicação de cola biológica entre as lâminas dissecadas ou sobre a sutura realizada.
A preservação da valva nativa, na maioria dos casos agudos, é conseguida simplesmente com a suspensão e a reconstituição do anel aórtico, deformado pela lâmina de dissecção. Só haverá necessidade de substituição valvar se houver dissecção sobreposta à síndrome de Marfan, à ectasia ânulo-aórtica ou à lesão valvar primária.
Nos casos de dissecção crônica, a valva aórtica tem sido preservada em porcentuais variáveis, embora na maioria dos casos seja preferida sua substituição. No Instituto do Coração da Faculdade de Medicina da Universidade de São Paulo (InCor/HC-FMUSP), a idéia tem sido a da preservação da valva, mesmo em casos menos favoráveis, atingindo cerca de 60% dos casos. Em estudo de casos consecutivos, verificamos durabilidade semelhante entre os casos de plastia e de substituição valvar(25).
Existem, no entanto, casos em que a alteração da porção inicial da aorta ascendente exige a substituição radical dessa porção. Nessas situações deve ser feito o reimplante dos óstios coronários pelas técnicas que utilizam tubos valvulados, que correspondem à técnica de Bentall e DeBono, de 1968 (Fig. 2), ou suas variantes, ou as técnicas de substituição radical, com preservação da valva nativa (técnica do remodelamento, 1993) (Fig. 3).
O acometimento dos óstios coronários conseqüente à lâmina de dissecção ou por hematoma local ocorre em 1,5% a 2,5% dos casos(26, 27). O óstio da coronária direita é o mais freqüentemente acometido; este pode ser simplesmente ligado e feita ponte de safena para essa artéria ou, ainda, ser reimplantado. Se o mesmo ocorrer com o óstio esquerdo, costuma ser necessária a realização da cirurgia proposta por Bentall e DeBono.
RESULTADOS
A mortalidade hospitalar é elevada e heterogênea nos diferentes grupos, tendendo a ser maior nos pacientes submetidos a correção da dissecção da aorta ascendente em sua fase aguda. Esse valores variaram entre 4,7% e 24%(23, 28-34). Foram indicados como variáveis pré-operatórias diretamente relacionadas a maior mortalidade pós-operatória, a isquemia cerebral e a insuficiência renal, assim como foi quando houve a necessidade de abordagem do arco aórtico (23%).
No InCor/HC-FMUSP, no período de 1980 a 1999, foram
realizadas 826 cirurgias em pacientes com doença da aorta torácica. Destas,
639 foram para correções das afecções da aorta ascendente. Das 639, 441
pacientes eram portadores de dissecção da aorta, sendo 234 ou 36,6% portadores
de dissecção aguda da aorta ascendente.
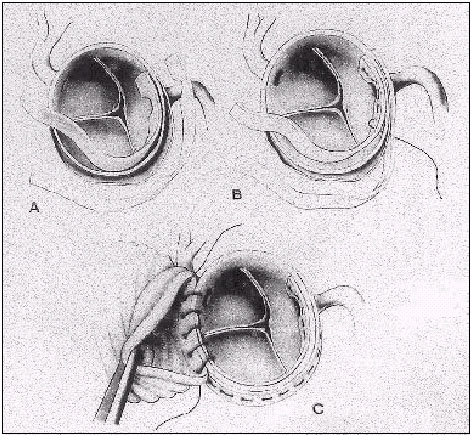 |
| Figura 1. A e B) Desenho esquemático da reconstrução da parede da aorta delaminada, por meio de reforço com tiras de teflon colocadas internamente e externamente à luz verdadeira da aorta. C) Sutura da aorta reforçada no enxerto vascular. |
A sobrevida dos pacientes submetidos a cirurgia da aorta ascendente durante período de seguimento de 5, 7 e 10 anos oscilou, respectivamente, entre 68% e 73%, 60% e 70%, e 52%(29, 31, 32).
Dos pacientes submetidos a tratamento conservador da valva
aórtica, 92% a 95% mantiveram-se livres de insuficiência significativa da
valva, por período de até dez anos de seguimento(25, 34, 35).
 |
| Figura 2. Desenho esquemático da técnica de Bentall e DeBono. A) Interposição do tubo valvulado. B) Reimplante do óstio da coronária direita após o reimplante do óstio esquerdo. |
 |
| Figura 3. Desenho esquemático da técnica do remodelamento. |
No InCor/HC-FMUSP, os pacientes submetidos a substituição da aorta ascendente com plastia da valva aórtica apresentaram mortalidade semelhante ao grupo que trocou a valva, respectivamente, de 11,1% e 12,5%.
A técnica de interposição do tubo vascular mostrou-se melhor quando comparada à técnica de inclusão, levando-se em conta mortalidade (p = 0,0154) e sobrevida tardia (p = 0,03). Não houve diferença para as complicações pós-operatórias como sangramento, infarto do miocárdio e baixo débito cardíaco(30).
No InCor/HC-FMUSP, durante o período de 1980 a 1999, foram operados 405 pacientes com diagnóstico de aneurisma ou dissecção crônica da aorta ascendente. Foram registrados 45 óbitos (11,1%), que, no período de 1980 a 1989, corresponderam a 14,6%, e no período de 1990 a 1999, a 9,8%.
Ao se associar a mortalidade intra-hospitalar desse grupo
de pacientes com as diferentes técnicas empregadas, observam-se resultados
também distintos. Pela técnica de Bentall e DeBono, foram obtidos 4,9% de
mortalidade; na operação de Cabrol, a mortalidade foi de 0%. Com a técnica do
remodelamento, a mortalidade foi de 8,3%; na substituição da aorta ascendente
supracoronária associada a troca valvar aórtica, foram registrados 12,5%; e
quando associada a plastia valvar, a mortalidade foi semelhante e igual a
11,1%. Na substituição da aorta ascendente associada a outro procedimento, a
mortalidade subiu para 28,8%
REFERÊNCIAS
1. DeBakey ME, McCoollum CH, Crawford ES, Morris GC Jr, Howell J, Noon GP, et al. Dissection and dissecting aneurysms of the aorta: twenty-year follow-up of five hundred twenty-seven patients treated surgically. Surgery 1982;92:1118-34.
2. Morgagni GB. De sedibus et causis morborum. Benetiis; 1761.
3. Shennan T. Dissecting Aneurysms. Medical Research Clinical Special Report Series no. 193. London: His Majesty's Stationery Office; 1934.
4. Anagnostopoulos CE, Prabhakar MJS, Kittle CF. Aortic dissections and dissecting aneurysms. Am J Cardiol 1972;30:263-73.
5. Hirst AE Jr, Johns VJ Jr, Kime SW Jr. Dissecting aneurysm of the aorta: a review of 505 cases. Baltimore: Medicine; 1958. pp.217-92.
6. Vecht RJ, Bromley LL, Besterman EMM, Eastcott JJH, Kenyon JR. Acute dissection of the aorta: long term review and management. Lancet 1980;1:109-11.
7. Gurin D, Bulmer JW, Derby R. Dissecting aneurysm of the aorta. Diagnosis and operative relief of acute arterial occlusion due to this cause. N Y State J Med 1935;35:1200-2.
8. Paullin JE, James DF. Dissecting aneurysm of the aorta. Postgrad Med 1948;4:291-9.
9. Johns TNP. Dissecting aneurysm of the abdominal aorta: report of a case with repair of perforation. Ann Surg 1953;137:232-5.
10. DeBakey ME, Cooley DA, Creech O Jr. Surgical considerations of dissecting aneurysm of the aorta. Ann Surg 1955;142:586-612.
11. Spencer FC, Blake H. A report of the successful surgical treatment of aortic regurgitation from a dissecting aortic aneurysm in a patient with the Marfan syndrome. J Thorac Cardiovasc Surg 1962;44:238-45.
12. Bahnson HT, Spencer FC. Excision of aneurysm of ascending aorta with prosthetic replacement during cardiopulmonary bypass. Ann Surg 1960;151:879-82.
13. Crawford ES, Coselli JS, Svensson LG. Diffuse aneurismal disease (chronic aortic dissection, Marfan and mega aorta syndromes) and multiple aneurysm. Ann Surg 1990;5:521-37.
14. Guilmet D, Bachet J, Goudot B. Use of biological glue in acute aortic dissections. A new surgical technique. Preliminary clinical results. J Thorac Cardiovasc Surg 1979;77:516-21.
15. Sabik JF, Lytle BW, McCarthy PM, Cosgrove DM. Axillary artery: an alternative site of arterial cannulation for patients with extensive aortic and peripheral vascular disease. J Thorac Cardiovasc Surg 1995;109:885-91.
16. Bichell DP, Balaguer JM, Aranki SF, Couper GS, Adams DH, Rizzo RJ, et al. Axilloaxillary cardiopulmonary bypass: a practical alternative to femorofemoral bypass. Ann Thorac Surg 1997;64:702-5.
17. Neri E, Massetti M, Capannini G, Carone E, Tucci E, Diciolla F, et al. Axillary artery cannulation in type A aortic dissection operations. J Thorac Cardiovasc Surg 1999;118:324-9.
18. Griepp RB, Stinson EB, Hollingsworth JF, Buehler D. Prosthetic replacement of aortic arch. J Thorac Cardiovasc Surg 1975;70:1051-62.
19. Ueda Y, Miki S, Kusuharaki OY. Surgical treatment of aneurysm or dissection involving the ascending aorta and aortic arch, utilizing circulatory arrest and retrograde cerebral perfusion. J Thorac Cardiovasc Surg 1990;31:553-8.
20. Cooley DA, Ott DA, Frazier OH, Walker WE. Surgical treatment of aneurysms of the transverse arch: experience with 25 patients using hypothermic techniques. Ann Thorac Surg 1981;32:260-72.
21. Stolf NAG, Fontes RD. Quando e como incluir o arco aórtico na correção da dissecção aórtica aguda proximal. Rev Soc Cardiol Estado de São Paulo 1994;4:472-5.
22. Vianna CB, Ramires JAF. Dissecções da aorta. Classificação, quadro clínico e história natural. Rev Soc Cardiol Estado de São Paulo 1994;4(5):422-6.
23. Fontes RD, Stolf NAG. Tratamento cirúrgico das dissecções aórticas agudas proximais. Rev Soc Cardiol Estado de São Paulo 1994;4:466-71.
24. Carvalho ACC. Estudo comparativo do ecocardiograma bidimensional transtorácico, tomografia computadorizada e cineangioaortografia nas dissecções da aorta torácica. (Tese de Livre-Docência) Escola Paulista de Medicina, São Paulo, 1992.
25. Dottori V, Spagnolo S, Passerone G, Lijoi A, Barberis L, Agostini M, et al. Ten years of surgery of aortic dissections and aneurysms. Clinical experience and original contributions. Minerva Cardioangiol 1992;40(11):431-6.
26. Slater EE, De Sanctis RW. The clinical recognition of dissecting aortic aneurysm. Am J Med 1976;60:625-33.
27. Hogan PJ. Medical management of dissecting thoracic aneurysms. Tex Heart Inst J 1990;17:281-8.
28. Crawford ES, Kirklin JW, Naftel DC, Svensson LG, Coselli JS, Safi HJ. Surgery for acute ascending aortic dissection: should the arch be included? J Thorac Cardiovasc Surg 1992;104:46-59.
29. Sabik JF, Lytle BW, Blackstone EH, McCarthy PM, Loop FD, Cosgrove DM. J Thorac Cardiovasc Surg 2000;5:946-62.
30. Niederhauser U, Rudiger H, Kunzli A, Seifert B, Schimidli J, Vogt P, et al. Surgery for acute type A aortic dissection: comparison of techniques. Eur J Cardiothorac Surg 2000;18(3):307-12.
31. Biglioli P, Parolari A, Spirito R, Musumeci S, Agrifoglio M, Alamanni AC, et al. Early and late results of ascending aorta surgery: risk factors for early and late outcome. World J Surg 1997;21(6):590-8.
32. Kouchoukos NT, Marshall WG, Wedige-Stecher TA. Eleven-year experience with composite graft replacement of the ascending aorta and aortic valve. J Thorac Cardiovasc Surg 1986;92(4):691-705.
33. Nguyen B, Muller M, Kipfer B, Berdat P, Walpoth B, Althaus U, et al. Different techniques of distal aortic repair in acute type A dissection: impact on late aortic morphology and reoperation. Eur J Cardiothorac Surg 1999;15(4):496-500.
34. Vrandecic M, Gontijo Filho B, Fantini F, Barbosa J, Martins I, Oliveira OC, et al. Use of bovine pericardial tissue for aortic valve and aortic root replacement: long-term results. J Heart Valve Dis 1998;7(2):195-201.
35. Meng RL, Najafi H, Javid H, Hunter JA, Goldin MD. Acute ascending
aortic dissection: surgical management. Circulation 1981;64:II231-II234.